
【题目】硅单质及其化合物应用范围很广.请回答下列问题
(1)制备硅半导体材料必须先得到高纯硅的主要方法,其生产过程示意图如图所示. 
①写出由纯SiHCl3制备高纯硅的化学反应方程式
②整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式,H2还原SiHCl3过程中若混入O2 , 可能引起的后果是 .
(2)硅酸钠水溶液俗称水玻璃.取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡.写出实验现象其产生原因: .
①2O2(g)+N2(g)=N2O4 , (l)△H1
②N2(g)+2H2(g)=N2H4(l)△H2
③O2(g)+2H2(g)=2H2O(g)△H3
④2N2 H4 (1)+N2O4 (1)=3N2 (g)+4H2O(g)△H4=﹣1048.9kJ/mol
上述反应热效应之间的关系式为△H4= , 联氨和N2O4可作为火箭助推剂,折算在标准状况下的数据,燃爆后气体的体积与燃爆前的体积之比为:
N2H4 | N2O4 | |
密度/g/cm3 | 1.004 | 1.44 |
(3)联氨为二元弱減,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为(已知:N2H4+H+N2H5+的K=8.7×107;KW=1.0×10﹣14),.联氨与硫酸形成的酸式盐的化学式为 .
(4)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是 . 联氨可用于处理锅炉水中的氧;防止锅炉被腐蚀,理论上1kg的联氨可除去水中溶解的O2kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是 .
【答案】
(1)SiHCl3+H2 ![]() Si+3HCl;高温下,H2遇O2发生爆炸
Si+3HCl;高温下,H2遇O2发生爆炸
(2)生成白色絮状沉淀,又刺激性气味的气体生成,SiO32﹣与NH4+发生双水解反应,生成氨气和硅酸沉淀;2△H3﹣2△H2﹣△H1;1228.6
(3)N2H6(HSO4)2
(4)固体逐渐变黑,并有气泡产生;1;N2H4的用量少,不产生其他杂质(反应产物为N2和H2O),而Na2SO3产生Na2SO4
【解析】解;(1)①在1357K的条件下,氢气和纯SiHCl3反应生成高纯硅和氯化氢:SiHCl3+H2 ![]() Si+3HCl,所以答案是:SiHCl3+H2
Si+3HCl,所以答案是:SiHCl3+H2 ![]() Si+3HCl;②SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:SiHCl3+3H2O═H2SiO3↓+H2↑+3HCl↑,H2还原SiHCl3过程中若混入O2 , 高温下,可能引起爆炸,所以答案是:SiHCl3+3H2O═H2SiO3↓+3HCl↑+H2↑;高温下,H2遇O2发生爆炸;(2)SiO32﹣与NH4+发生双水解反应生成白色絮状沉淀,又刺激性气味的气体生成,方程式为:SiO32﹣+2NH4++2H2O═2NH3H2O+H2SiO3↓,
Si+3HCl;②SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:SiHCl3+3H2O═H2SiO3↓+H2↑+3HCl↑,H2还原SiHCl3过程中若混入O2 , 高温下,可能引起爆炸,所以答案是:SiHCl3+3H2O═H2SiO3↓+3HCl↑+H2↑;高温下,H2遇O2发生爆炸;(2)SiO32﹣与NH4+发生双水解反应生成白色絮状沉淀,又刺激性气味的气体生成,方程式为:SiO32﹣+2NH4++2H2O═2NH3H2O+H2SiO3↓,
所以答案是:生成白色絮状沉淀,又刺激性气味的气体生成,SiO32﹣与NH4+发生双水解反应,生成氨气和硅酸沉淀;(3)①2O2(g)+N2(g)═N2O4(l)△H1②N2(g)+2H2(g)═N2H4(l)△H2③O2(g)+2H2(g)═2H2O(g)△H3
依据热化学方程式和盖斯定律计算③×2﹣②×2﹣①得到④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=2△H3﹣2△H2﹣△H1 , 根据反应④可知,折算在标准状况下的数据,燃爆后气体的体积与燃爆前的体积之比为: ![]() =
= ![]() =1228.6,所以答案是:2△H3﹣2△H2﹣△H1;1228.6;(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离方程式为N2H4+H2ON2H5++OH﹣ , 平衡常数Kb=
=1228.6,所以答案是:2△H3﹣2△H2﹣△H1;1228.6;(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离方程式为N2H4+H2ON2H5++OH﹣ , 平衡常数Kb= ![]() =
= ![]() ,×
,× ![]() =K×Kw=8.7×107×1.0×10﹣14=8.7×10﹣7 , 第二步电离方程式为N2H5++H2ON2H62++OH﹣ , 因此联氨与硫酸形成的酸式盐为N2H6(HSO4)2 , 所以答案是:8.7×10﹣7;N2H6(HSO4)2;(4)联胺被银离子氧化,银离子被还原生成单质银,﹣2价的N元素被氧化为N2 , 反应方程式为:N2H4+4AgBr=4Ag↓+N2↑+4HBr,因此反应出现现象为:固体逐渐变黑,并有气泡产生,由于肼的氧化产物是氮气,不会对锅炉造成腐蚀,而亚硫酸钠被氧化产物为硫酸钠,易生成硫酸盐沉淀影响锅炉的安全使用,联胺被氧化失电子N2H4→N2失去4e﹣ , O2→O2﹣得到4e﹣ , 联胺和氧气摩尔质量都是32g/mol,则等质量联胺和氧气物质的量相同,理论上1kg的联氨可除去水中溶解的O21kg,与使用Na2SO3处理水中溶解的O2相比,联氨的优点是用量少,不产生其他杂质(反应产物为N2和H2O),而Na2SO3产生Na2SO4 ,
=K×Kw=8.7×107×1.0×10﹣14=8.7×10﹣7 , 第二步电离方程式为N2H5++H2ON2H62++OH﹣ , 因此联氨与硫酸形成的酸式盐为N2H6(HSO4)2 , 所以答案是:8.7×10﹣7;N2H6(HSO4)2;(4)联胺被银离子氧化,银离子被还原生成单质银,﹣2价的N元素被氧化为N2 , 反应方程式为:N2H4+4AgBr=4Ag↓+N2↑+4HBr,因此反应出现现象为:固体逐渐变黑,并有气泡产生,由于肼的氧化产物是氮气,不会对锅炉造成腐蚀,而亚硫酸钠被氧化产物为硫酸钠,易生成硫酸盐沉淀影响锅炉的安全使用,联胺被氧化失电子N2H4→N2失去4e﹣ , O2→O2﹣得到4e﹣ , 联胺和氧气摩尔质量都是32g/mol,则等质量联胺和氧气物质的量相同,理论上1kg的联氨可除去水中溶解的O21kg,与使用Na2SO3处理水中溶解的O2相比,联氨的优点是用量少,不产生其他杂质(反应产物为N2和H2O),而Na2SO3产生Na2SO4 ,
所以答案是:固体逐渐变黑,并有气泡产生;1;N2H4的用量少,不产生其他杂质(反应产物为N2和H2O),而Na2SO3产生Na2SO4 .


科目:高中化学 来源: 题型:
【题目】按要求填空
(1)根据官能团的不同对下列有机物进行分类:(填序号)
①CH3CH2OH② ![]() ③CH3CH2Br④
③CH3CH2Br④ ![]() ⑤
⑤ ![]() ⑥
⑥ 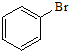 ⑦
⑦ ![]() ⑧
⑧ ![]() ⑨
⑨  ⑩
⑩ 
属于芳香烃的是 ;属于卤代烃的是 ;属于醇的是 ;属于酚的是 ;属于醛的是 ;属于酮的是 ;属于羧酸的是 ;属于酯的是 .
(2)有机化学中的反应类型较多,将下列反应归类:(填序号)
①乙烯使酸性高锰酸钾溶液褪色 ②由乙烯制备聚乙烯
③甲烷与氯气在光照条件下的反应 ④由乙炔制氯乙烯
属于取代反应的是 ;属于加成反应的是 ;属于加聚反应的是 ;属于氧化反应的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2010年上海世博会将实现环保世博、生态世博目标,下列做法中不符合这一目标的是( )
A.部分国家的展馆使用可降解的建筑材料
B.把世博会期间产生的垃圾焚烧或深埋处理
C.某些馆的外壳使用非晶硅薄膜,以充分利用太阳能
D.停车场安装了催化光解设施,用于处理汽车尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某澄清、透明的浅黄色溶液中,可能含有下列八种离子:H+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、S2-,在检验方案设计时初步分析其溶液中最多可含离子(只从这8种离子中选择)有( )
A.4种B.5种C.6种D.7种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列反应的反应类型的判断,不正确的是 ( )
A. SO3+H2O=H2SO4 化合反应
B. Fe2O3+3CO![]() 2Fe+3CO2 置换反应
2Fe+3CO2 置换反应
C. Cu(OH)2![]() CuO+H2O 分解反应
CuO+H2O 分解反应
D. NaCl +AgNO3=AgCl↓+NaNO3 复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学购买了一瓶:“84消毒液”,包装说明如下:
净含量:1000 mL 密度:1.19 g·cm-3
主要成分:25%NaC1O
使用方法:稀释l00倍(体积比)后使用
注意亊项:密封保存,易吸收空气中的CO2变质
请根据以上信息和相关知识判断,下列分析不正确的是
A. 该“84消毒液”的物质的量浓度约为4.0 mol·L-1
B. 一瓶该“84消毒液”中含NaC1O的质量为297.5g
C. 取l00mL该“84消毒液”稀释100倍后用以消毒,稀释后的溶液中c(Na+)约为0.04 mol·L-1
D. 参阅该“84消毒液”的配方,欲用NaClO固体配制25%NaClO的消毐液480 mL,需要称量的NaClO固体质量为I43g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)在一条鱼、虾绝迹的小河边有四座工厂甲、乙、丙、丁(如下图),它们排出的废液里,每个工厂只有Na2CO3、CuCl2、Ca(OH)2、HC1中的一种。某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈浅蓝色浑浊:③丙处河水由浑变淸:④丁处产生气泡,河水仍淸,请推断:

(1)工厂棑除的废液里含有的污染物:甲_______,乙_____________。
(2)写出④中有关反应的离子方程式___________________。
(II)X、Y、Z三种物质有如下转化关系:

(1)根据上述转化关系,写出下列物质的化学式:X_______、试剂乙________________。
(2)写出③步反应的离子方程式:③___________________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com