
【题目】将铜片在空气中灼烧变黑,趁热伸入下列物质中,铜片的质量发生变化的是( )
A. 氢气B. 一氧化碳C. 二氧化碳D. 乙醇蒸汽
科目:高中化学 来源: 题型:
【题目】在Na2CO3和HCl反应的下列各组实验中,反应速率最快的一组是
组号 | 温度(℃) | Na2CO3浓度(mol/L) | HCl浓度(mol/L) |
A | 20 | 0.1 | 0.2 |
B | 20 | 0.2 | 0.2 |
C | 10 | 0.2 | 0.4 |
D | 20 | 0.2 | 0.4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题:
(Ⅰ)下列一组有水参与的反应:
①2Na + 2H2O = 2NaOH + H2↑ ②2Na2O2 + 2H2O = 4NaOH + O2↑
③Na2O + H2O =2NaOH ④2H2O![]() 2H2↑+ O2↑ ⑤2F2 + 2H2O = 4HF + O2
2H2↑+ O2↑ ⑤2F2 + 2H2O = 4HF + O2
(1)其中不属于氧化还原反应的是____________(填编号)
(2)在这些氧化还原反应中,水只作氧化剂的反应是___________(填编号);水只作还原
剂的反应是___________(填编号);水既作氧化剂,又作还原剂是_________(填编号);水既不作氧化剂,又不作还原剂是___________(填编号)。
(3)根据你的理解,氧化还原反应的特征是_____。
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?______(填“是”或“不是”),若是,这个反应的氧化剂是_________,氧化产物是________,被氧化的氮元素与被还原的氮元素的物质的量之比是______;如果3mol的NO2完全反应,应转移____________个电子。
(Ⅱ)现有以下物质:(填序号)
① 铜 ② CO2 ③ 水 ④ CaCO3固体 ⑤ 蔗糖
以上物质中能导电的是______________,以上物质中属于电解质的是____________,以上物质中属于非电解质的________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要 0.1mol/L的 H2SO4溶液980mL,欲用 98%、密度为1.84g/cm3的浓硫酸配制.
(1)所需的主要仪器除量筒、烧杯、玻璃棒外,还需要___________、______________。
(2)其实验操作步骤可分为以下几步:
A.用量筒量取_______mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。
B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):_____________________
( D )→( A )→( C )→( )→( )→( )→( F )。
③将浓硫酸在烧杯中稀释后移入容量瓶时,必须_________________方可移液.
(3)试分析下列操作对所配溶液的浓度有何影响
①量取浓硫酸时眼睛俯视量筒刻度线,会导致所配溶液浓度会_________;(填: 偏高、偏低、或无影响,下同)
②定容时,眼睛仰视刻度线,所配溶液浓度会____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物应用范围很广.请回答下列问题
(1)制备硅半导体材料必须先得到高纯硅的主要方法,其生产过程示意图如图所示. 
①写出由纯SiHCl3制备高纯硅的化学反应方程式
②整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式,H2还原SiHCl3过程中若混入O2 , 可能引起的后果是 .
(2)硅酸钠水溶液俗称水玻璃.取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡.写出实验现象其产生原因: .
①2O2(g)+N2(g)=N2O4 , (l)△H1
②N2(g)+2H2(g)=N2H4(l)△H2
③O2(g)+2H2(g)=2H2O(g)△H3
④2N2 H4 (1)+N2O4 (1)=3N2 (g)+4H2O(g)△H4=﹣1048.9kJ/mol
上述反应热效应之间的关系式为△H4= , 联氨和N2O4可作为火箭助推剂,折算在标准状况下的数据,燃爆后气体的体积与燃爆前的体积之比为:
N2H4 | N2O4 | |
密度/g/cm3 | 1.004 | 1.44 |
(3)联氨为二元弱減,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为(已知:N2H4+H+N2H5+的K=8.7×107;KW=1.0×10﹣14),.联氨与硫酸形成的酸式盐的化学式为 .
(4)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是 . 联氨可用于处理锅炉水中的氧;防止锅炉被腐蚀,理论上1kg的联氨可除去水中溶解的O2kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeSO4[含Al2(SO4)3和少量重金属离子],可以生产电池级高纯超微细草酸亚铁.其工艺流程如图1: 
已知:①5Fe2++MnO ![]() +8H+═5Fe3++Mn2++4H2O
+8H+═5Fe3++Mn2++4H2O
②5C2O42﹣+2MnO ![]() +16H+═10CO2↑+2Mn2++8H2O
+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有
(2)滤液Ⅱ经处理可得到副产品 .
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25mL 2molL﹣1的H2SO4溶解.
步骤2:用0.2000molL﹣1标准KMnO4溶液滴定,消耗其体积30.40mL.
步骤3:向滴定后的溶液中加入2g Zn粉和5mL 2molL﹣1的H2SO4溶液,将Fe3+还原为Fe2+ .
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.40mL.
则样品中C2O42﹣的物质的量为 .
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图2,产生这种变化趋势的原因可能为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】防治环境污染,改善生态环境已成为全球共识.
①下列各图中表示我国节能标志的是(填字母).
②煤矿有时会发生瓦斯爆炸事故,瓦斯的主要成分与天然气相同,写出瓦斯爆炸的化学方程式: .
③环境污染已对人类造成重大威胁.下列名词与环境污染无关的是
A.潮汐B.温室效应C.臭氧层空洞D.工业废水
④减少室内空气污染,下列措施正确的是
A、在室内种植芦荟、常青藤等绿色植物
B、随意对室内装饰,装饰材料可以随意用
C、紧闭门窗
D、室内有异味时,要即时多喷洒香水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeSO4[含Al2(SO4)3和少量重金属离子],可以生产电池级高纯超微细草酸亚铁.其工艺流程如图1: 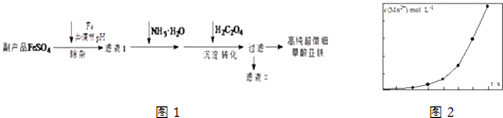
已知:①5Fe2++MnO ![]() +8H+═5Fe3++Mn2++4H2O
+8H+═5Fe3++Mn2++4H2O
②5C2O42﹣+2MnO ![]() +16H+═10CO2↑+2Mn2++8H2O
+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有
(2)滤液Ⅱ经处理可得到副产品 .
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25mL 2molL﹣1的H2SO4溶解.
步骤2:用0.2000molL﹣1标准KMnO4溶液滴定,消耗其体积30.40mL.
步骤3:向滴定后的溶液中加入2g Zn粉和5mL 2molL﹣1的H2SO4溶液,将Fe3+还原为Fe2+ .
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.40mL.
则样品中C2O42﹣的物质的量为 .
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图2,产生这种变化趋势的原因可能为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】〔化学﹣﹣选修2:化学与技术〕 锌锰电池(俗称干电池)在生活中的用量很大.两种锌锰电池的构造如图(a)所示.回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2═Zn(NH3)2Cl2+2MnOOH ①该电池中,负极材料主要是 , 电解质的主要成分是 , 正极发生的主要反应是 .
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是 .
(2)图(b)表示回收利用废旧普通锌锰电池工艺(不考虑废旧电池中实际存在的少量其他金属). 
①图(b)中产物的化学式分别为A , B .
②操作a中得到熔块的主要成分是K2MnO4 . 操作b中,绿色的K2MnO4溶液反应生成紫色溶液和一种黑褐色固体,该反应的离子方程式为 .
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是(填化学式).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com