
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中硫酸作氧化剂 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 1mol NH4CuSO3完全反应转移0.05mol电子 | |
| D. | 刺激性气味的气体是SO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SiO3$\stackrel{△}{→}$SiO2$\stackrel{HCl(aq)}{→}$SiCl4 | |
| B. | S$→_{催化剂/△}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | Ca(ClO)2(aq)$\stackrel{CO_{2}}{→}$HClO(aq)$\stackrel{光照}{→}$HCl(aq) | |
| D. | Fe$→_{△}^{少量Cl_{2}}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2$\stackrel{空气中放置}{→}$Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
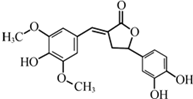
| A. | 分子中含有三种含氧官能团 | |
| B. | 既能与FeC13发生显色反应,也能和Na2CO3反应 | |
| C. | 既可以发生取代反应,又能够发生加成反应 | |
| D. | 1 mol该化合物最多能与6molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
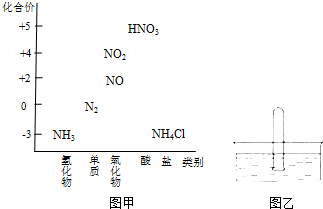 图甲为氮及其化合物的类别与化合价对应的关系图.
图甲为氮及其化合物的类别与化合价对应的关系图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com