
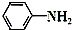
 +CH3COOH$\stackrel{△}{→}$
+CH3COOH$\stackrel{△}{→}$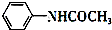 +H2O
+H2O| 试剂名称 | 熔点℃ | 沸点℃ | 溶解度(20℃) |
| 苯胺 | -6.2 | 184.4 | 稍溶于水(3.4g),与乙醇、乙醚、苯混溶 |
| 乙酸 | 16.7 | 118 | 易溶于水、乙醇、乙醚等 |
| 乙酰苯胺 | 114~116 | 280~290 | 0.46g |
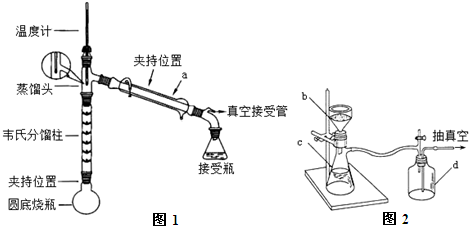
分析 (1)根据仪器的特征与用途分析仪器A为冷凝管;
(2)苯胺不稳定,容易被空气中的氧气氧化为硝基苯,为防止苯胺在反应过程中被氧化,需要加入还原剂Zn粉,同时起着沸石的作用;
(3)温度过高,乙酸蒸出,控制温度,防止未反应的乙酸蒸出,降低了反应物的利用率,加热至105℃左右,就可以不断分出反应过程中生成的水,促进反应正向进行,温度过低,不能除去反应生成水;
(4)仪器B的名称吸滤瓶,当过滤的溶液具有强酸性、强碱性或强氧化性时,会腐蚀滤纸,要用玻璃纤维代替滤纸或用玻璃砂漏斗,抽滤完毕,停止抽滤时的操作要防止倒吸.
解答 解:(1)由仪器的结构特征,控制仪器A为冷凝管,起冷凝回流作用,故答案为:冷凝管;
(2)苯胺不稳定,容易被空气中的氧气氧化为硝基苯,加入还原剂Zn粉,可以防止苯胺在反应过程中被氧化,苯胺、醋酸的沸点低,加热易沸腾,所以加入锌粉同时起着沸石的作用,
故答案为:防止苯胺被氧化,同时起着沸石的作用;
(3)乙酸有挥发性,温度过高,乙酸蒸出,降低了反应物的利用率,水的沸点是100℃,加热至105℃左右,就可以不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率,温度过低,不能除去反应生成水,
故答案为:乙酸有挥发性,温度过高,乙酸蒸出,降低了反应物的利用率,而温度过低,不能除去反应生成水;
(4)仪器B的名称吸滤瓶,当过滤的溶液具有强酸性、强碱性或强氧化性时,会腐蚀滤纸,玻璃纤维为硅酸盐材料,具有耐强酸性、强碱性,所以需用玻璃纤维代替滤纸或用玻璃砂漏斗,停止抽滤时一定要先旋开安全瓶d上的旋塞恢复常压然后关闭抽气泵,然后取漏斗滤纸上的沉淀,防止倒吸,
故答案为:吸滤瓶;玻璃纤维代替滤纸或用玻璃砂漏斗;先旋开安全瓶d上的旋塞恢复常压然后关闭抽气泵.
点评 本题考查有机物制备方案设计,涉及物质的分离提纯、基本操作等,理解实验原理和物质的性质是解题的关键,是对学生综合能力的考查,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种酸的电离常数:Ki1(H2CO3)>Ki(HX)>Ki(HY)>Ki2(H2CO3) | |
| B. | NaX溶液中通入足量CO2后的离子浓度:c(HCO3-)>c(CO32-)>c(X-) | |
| C. | 同浓度溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| D. | 结合H+的能力:Y->CO32->X->HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
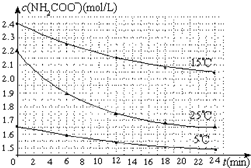 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaClO溶液:ClO-+H2O═HClO+OH- | B. | FeCl3溶液:Fe3++3H2O?Fe(OH)3↓+3H+ | ||
| C. | Na2S溶液:S2-+H2O?H2S+2OH- | D. | NH4Cl溶液:NH4++H2O?NH3•H2O+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中不存在游离态的硫 | |
| B. | 二氧化硫的排放会导致光化学烟雾的产生 | |
| C. | 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性 | |
| D. | 硫粉在过量的纯氧中燃烧也不能生成三氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯气溶于水:Cl2+H2O═H++Cl-+HClO | |
| B. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O | |
| D. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在恒容密闭容器中加入一定量的反应物后存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),平衡时CO2物质的量浓度与温度的关系如图所示,下列说法错误的是( )
在恒容密闭容器中加入一定量的反应物后存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),平衡时CO2物质的量浓度与温度的关系如图所示,下列说法错误的是( )| A. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 | |
| B. | 在T2时,D点的反应速率:ν(逆)>ν(正) | |
| C. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com