
| A. | 三种酸的电离常数:Ki1(H2CO3)>Ki(HX)>Ki(HY)>Ki2(H2CO3) | |
| B. | NaX溶液中通入足量CO2后的离子浓度:c(HCO3-)>c(CO32-)>c(X-) | |
| C. | 同浓度溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| D. | 结合H+的能力:Y->CO32->X->HCO3- |
分析 根据题意写出方程式:
CO2+H2O+NaX=HX+NaHCO3;HX+Na2CO3=NaHCO3+NaX;
CO2+H2O+2NaY=2HY+Na2CO3;NaHCO3+NaY=HY+Na2CO3;
利用强酸制弱酸的原理判断出酸性:H2CO3>HX>NaHCO3>HY,
碱性强弱可以利用越弱越水解判断:NaHCO3<NaX<Na2CO3<NaY,据此分析.
解答 解:A.向NaX溶液中通入CO2气体,只能生成HX和NaHCO3,则酸性H2CO3>HX>NaHCO3,向NaY溶液中通入CO2,只生成HY和Na2CO3,则酸性NaHCO3>HY,则有酸性由强到弱:H2CO3>HX>HCO3->HY,酸性越强,电离常数越大,所以三种酸的电离常数:Ki1(H2CO3)>Ki(HX)>Ki2(H2CO3)>Ki(HY),故A错误;
B.向NaX溶液中通入足量CO2后生成HX和NaHCO3,由于酸性HX>HCO3-,所以c(X-)>c(CO32-),则c(HCO3-)c(X-)>c(CO32-),故B错误;
C.酸性H2CO3>HX>NaHCO3>HY,碱性强弱可以利用越弱越水解判断,所以溶液的碱性:NaHCO3<NaX<Na2CO3<NaY,故C错误;
D.由A可知酸性H2CO3>HX>NaHCO3>HY,则结合质子能力:Y->CO32->X->HCO3-,故D正确.
故选D.
点评 本题考查离子浓度的大小比较,题目难度较大,注意根据通入二氧化碳的反应判断酸的强弱是解答该题的关键,做题时注意体会.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
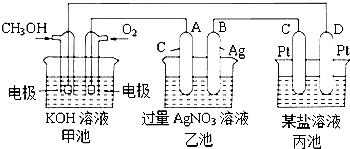 图是一个化学过程的示意图.
图是一个化学过程的示意图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
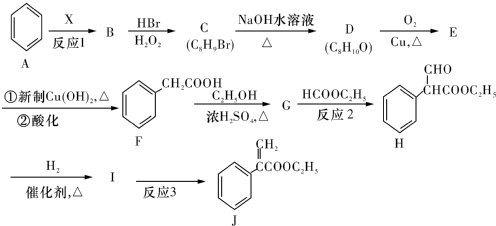
 (或碳碳双键).
(或碳碳双键). .
.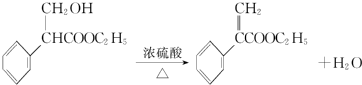 .
.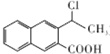 为起始原料制备
为起始原料制备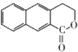 的合成路线
的合成路线 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3、KOH | B. | KAlO2、HCl | C. | KHCO3、HNO3 | D. | Na2CO3、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol/L乙酸溶液中 H+数为0.1NA | |
| B. | 16g甲烷分子中所含质子数为10NA | |
| C. | 0.1molCnH2n+2中含有的C-C键数为0.1nNA | |
| D. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小、减小、增大 | B. | 减小、增大、增大 | C. | 增大、减小、减小 | D. | 减小、增大、减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
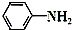 +CH3COOH$\stackrel{△}{→}$
+CH3COOH$\stackrel{△}{→}$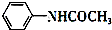 +H2O
+H2O| 试剂名称 | 熔点℃ | 沸点℃ | 溶解度(20℃) |
| 苯胺 | -6.2 | 184.4 | 稍溶于水(3.4g),与乙醇、乙醚、苯混溶 |
| 乙酸 | 16.7 | 118 | 易溶于水、乙醇、乙醚等 |
| 乙酰苯胺 | 114~116 | 280~290 | 0.46g |
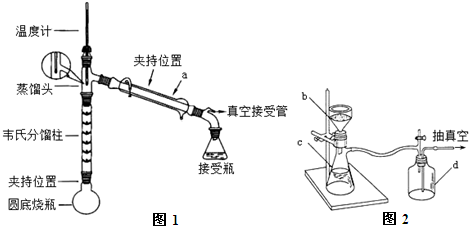
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | 混合气体的平均相对分子质量 | D. | $\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com