
| A. | 1L0.1mol/L乙酸溶液中 H+数为0.1NA | |
| B. | 16g甲烷分子中所含质子数为10NA | |
| C. | 0.1molCnH2n+2中含有的C-C键数为0.1nNA | |
| D. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA |
分析 A.醋酸是弱酸,部分电离;
B.一个甲烷分子中含有10个质子;
C.依据烷烃分子结构特征计算碳碳键数;
D.标准状况下,CHCl3不是气体.
解答 解:A.1L0.1mol•L-1乙酸溶液中含有0.1mol醋酸,由于醋酸是弱酸,溶液中部分电离出氢离子,所以电离的H+数小于0.1NA,故A错误;
B.16g甲烷的物质的量为1mol,1mol甲烷中含有10mol质子,所含质子数为10NA,故B正确;
C.烷烃是饱和链烃,0.1molCnH2n+2中含有的C-C键数为0.1(n-1)NA,故C错误;
D.标准状况下,CHCl3不是气体,不能带入n=$\frac{V}{{V}_{m}}$计算,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的条件应用,化学键数的方法与判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
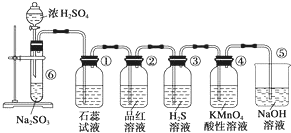 图是实验室制取SO2并验证SO2的某些性质的装置,试回答:
图是实验室制取SO2并验证SO2的某些性质的装置,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴入足量盐酸,如观察到无色无味的气体产生,且能使澄清石灰水变浑浊,即证明溶液中必定有CO32- | |
| B. | 向某无色溶液中加入BaCl2溶液,有白色沉淀出现,再加入稀盐酸,沉淀不消失,无法证明溶液一定含有SO42- | |
| C. | 向某无色溶液中加入少量稀氢氧化钠溶液后,用湿润的蓝色石蕊试纸靠近试管口,若试纸变红,则说明该溶液中有NH4+ | |
| D. | 如透过蓝色的钴玻璃能够观察到紫色火焰,则一定有钾元素,一定不含有钠元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含硫原子数目之比是 5:4 | B. | 氧原子的物质的量之比为 3:2 | ||
| C. | 氧元素的质量之比为 6:5 | D. | 硫元素的质量之比为 4:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种酸的电离常数:Ki1(H2CO3)>Ki(HX)>Ki(HY)>Ki2(H2CO3) | |
| B. | NaX溶液中通入足量CO2后的离子浓度:c(HCO3-)>c(CO32-)>c(X-) | |
| C. | 同浓度溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| D. | 结合H+的能力:Y->CO32->X->HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
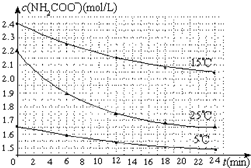 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中不存在游离态的硫 | |
| B. | 二氧化硫的排放会导致光化学烟雾的产生 | |
| C. | 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性 | |
| D. | 硫粉在过量的纯氧中燃烧也不能生成三氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com