
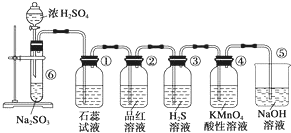
 图是实验室制取SO2并验证SO2的某些性质的装置,试回答:
图是实验室制取SO2并验证SO2的某些性质的装置,试回答:分析 (1)亚硫酸钠与浓硫酸反应生成二氧化硫、硫酸钠和水;
(2)二氧化硫溶于水和水反应生成亚硫酸,亚硫酸为弱酸;酸可以使紫色石蕊试液变红;
(3)二氧化硫与品红化合生成无色物质,能使品红溶液褪色;
(4)SO2中+4价S具有氧化性,硫化氢中-2价S具有还原性,二氧化硫能把硫化氢氧化成单质硫,本身被还原成单质硫;
(5)二氧化硫具有还原性,能够被KMnO4溶液氧化,二氧化硫具有还原性;
(6)二氧化硫有毒,不能直接排放到空气中,为酸性氧化物能够与氢氧化钠反应生成亚硫酸钠和水.
解答 解:(1)⑥中为亚硫酸钠和浓硫酸反应生成二氧化硫气体,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;
(2)①中为紫色石蕊试液,二氧化硫溶于水和水反应生成亚硫酸,SO2+H2O?H2SO3,亚硫酸为弱酸,可以使紫色石蕊试液变红,
故答案为:试液变为红色; 酸性;
(3)②中为品红溶液,二氧化硫与品红化合生成无色物质,能使品红溶液褪色,故二氧化硫具有漂白性,
故答案为:褪色;漂白性;
(4)SO2中+4价S具有氧化性,硫化氢中-2价S具有还原性,二氧化硫能把硫化氢氧化成单质硫,本身被还原成单质硫,反应方程式为SO2+2H2S=3S↓+2H20,
故答案为:有淡黄色沉淀生成;氧化;
(5)酸性KMnO4具有强氧化性,溶液颜色为紫色,SO2中+4价S具有还原性,二氧化硫通入酸性高锰酸钾中发生2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4,该反应中二氧化硫为还原剂,具有还原性,发生氧化反应,导致酸性KMnO4溶液褪色,
故答案为:KMnO4溶液褪色;还原;
(6)二氧化硫有毒,不能直接排放到空气中,二氧化硫酸性氧化物能够与氢氧化钠反应生成亚硫酸钠和水,所以可以用氢氧化钠溶液吸收二氧化硫,反应的化学方程式为:2NaOH+SO2=Na2SO3+H2O,
故答案为:吸收SO2,防止SO2污染环境;SO2+2NaOH=Na2SO3+H2O.
点评 本题考查了SO2的性质的实验设计和性质分析判断,掌握二氧化硫酸性氧化物性质、漂白性、氧化性和还原性等是解题关键,题目难度中等.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
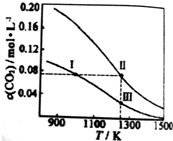
| A. | 反应CO2(g)+c(s)?2CO(g)△H<0 | |
| B. | 反应速率:V逆(状态Ⅰ)>V逆(状态Ⅲ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| D. | 体系的压强:2P总(状态Ⅰ)>P总(状态Ⅱ)>P总(状态Ⅰ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不变、减小 | B. | 增大、减小 | C. | 减小、增大 | D. | 不变、增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
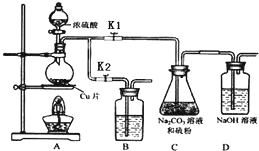 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
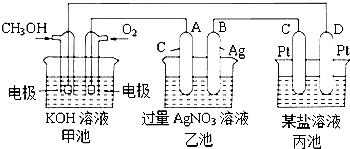 图是一个化学过程的示意图.
图是一个化学过程的示意图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电解质溶液 | H2SO4溶液 | KOH溶液 |
| 负极反应式 | ||
| 正极反应式 | ||
| 溶液的pH变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积比1:1 | B. | 体积比11:16 | C. | 分子个数比1:1 | D. | 密度比11:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol/L乙酸溶液中 H+数为0.1NA | |
| B. | 16g甲烷分子中所含质子数为10NA | |
| C. | 0.1molCnH2n+2中含有的C-C键数为0.1nNA | |
| D. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com