
| 电解质溶液 | H2SO4溶液 | KOH溶液 |
| 负极反应式 | ||
| 正极反应式 | ||
| 溶液的pH变化 |
分析 (1)根据电池反应式可知在反应中H2被氧化,O2被还原.H2应该在负极上反应,O2应该在正极上反应;
(2)酸性溶液,此时应考虑不可能有OH-生成,所以负极发生氧化反应,电极反应为H2-2e-=2H+,正极发生还原反应,电极反应为O2+4H++4e-=2H2O,生成水导致氢离子浓度减少,pH增大;H2应该在负极上反应,O2应该在正极上反应,又因为是碱性溶液,不可能有H+参加或生成,生成水导致氢氧根离子的浓度减小;
(3)如把H2改为甲烷,KOH溶液做电解质,甲烷在负极失电子发生氧化反应在碱溶液中生成碳酸盐.
解答 解:(1)根据电池反应式可知在反应中H2被氧化,O2被还原.H2应该在负极上反应,O2应该在正极上反应,故答案为:H2;O2;
(2)酸性溶液,此时应考虑不可能有OH-生成,所以负极发生氧化反应,电极反应为H2-2e-=2H+,正极发生还原反应,电极反应为O2+4H++4e-=2H2O,生成水导致氢离子浓度减少,pH增大,所以H2SO4溶液:负极:H2-2e-=2H+;正极:O2+4H++4e-=2H2O;溶液的pH变化:增大;
H2应该在负极上反应,O2应该在正极上反应,正极的电极反应为O2+2H2O+4e-=4OH-;又因为是碱性溶液,不可能有H+参加或生成,故负极的电极反应为H2-2e-+2OH-=2H2O,生成水导致氢氧根离子的浓度减小,所以溶液的pH减小,所以KOH溶液:负极:H2-2e-+2OH-=2H2O;正极:O2+2H2O+4e-=4OH-;溶液的pH变化:减小,
故答案为:
| 电解质溶液 | H2SO4溶液 | KOH溶液 |
| 负极反应式 | H2-2e-=2H+ | H2-2e-+2OH-=2H2O |
| 正极反应式 | O2+4H++4e-=2H2O | O2+2H2O+4e-=4OH- |
| 溶液的pH变化 | 增大 | 减小 |
点评 本题考查了原电池原理、组成、电极名称和电极反应的分析判断,注意不同电解质溶液中电极反应产物的书写,掌握基础是关键,题目难度中等.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
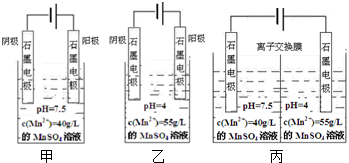
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
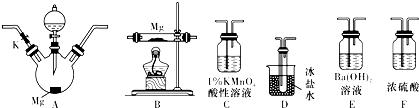
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
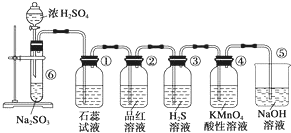 图是实验室制取SO2并验证SO2的某些性质的装置,试回答:
图是实验室制取SO2并验证SO2的某些性质的装置,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3、H2SiO3、HClO都属于弱酸 | B. | Na2O、MgO、Al2O3都属于碱性氧化物 | ||
| C. | 石英、纯碱、明矾都属于盐 | D. | 碱石灰、铁红、水泥都属于混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴入足量盐酸,如观察到无色无味的气体产生,且能使澄清石灰水变浑浊,即证明溶液中必定有CO32- | |
| B. | 向某无色溶液中加入BaCl2溶液,有白色沉淀出现,再加入稀盐酸,沉淀不消失,无法证明溶液一定含有SO42- | |
| C. | 向某无色溶液中加入少量稀氢氧化钠溶液后,用湿润的蓝色石蕊试纸靠近试管口,若试纸变红,则说明该溶液中有NH4+ | |
| D. | 如透过蓝色的钴玻璃能够观察到紫色火焰,则一定有钾元素,一定不含有钠元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
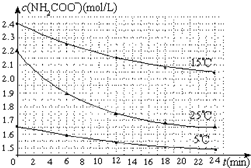 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com