
【题目】常温下,0.1mol·L-1某一元酸HA溶液中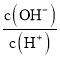 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10mol·L-1
B.溶液中c(H+)+c(A-)=0.1mol·L-1
C.常温下将HA稀释10倍,氢离子浓度变为原来的十分之一
D.上述溶液加NaA晶体,溶液的c(OH-)增大
【答案】D
【解析】
常温下,0.1mol·L-1某一元酸HA溶液中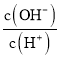 =1×10-8,结合水的离子积常数Kw=c(H+)c(OH-)=10-14,计算溶液中的氢离子浓度,判断该酸是强酸或弱酸,计算可得到c(H+)=10-3mol/L,说明该酸是弱酸,依据弱酸存在的电离平衡分析计算。
=1×10-8,结合水的离子积常数Kw=c(H+)c(OH-)=10-14,计算溶液中的氢离子浓度,判断该酸是强酸或弱酸,计算可得到c(H+)=10-3mol/L,说明该酸是弱酸,依据弱酸存在的电离平衡分析计算。
常温下,0.1mol·L-1某一元酸HA溶液中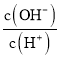 =1×10-8,又水的离子积常数Kw=c(H+)c(OH-)=10-14,解得c(H+)=10-3mol/L,说明该酸是弱酸,
=1×10-8,又水的离子积常数Kw=c(H+)c(OH-)=10-14,解得c(H+)=10-3mol/L,说明该酸是弱酸,
A. 该溶液中c(OH-)=1×1011molL1,OH-全部是由水电离的,则由水电离出的c(H+)=1×1011molL1,A项错误;
B. 溶液中存在物料守恒c(HA)+c(A)=0.1molL1,弱酸的电离是微弱的,c(H+)小于c(HA),则c(H+)+c(A-)<0.1mol·L-1,B项错误;
C. 常温下将HA稀释10倍,若不考虑平衡移动,氢离子浓度变为原来的十分之一,但加水稀释促进HA电离,电离出氢离子浓度大于原来的十分之一,C项错误;
D. 上述溶液存在电离平衡HAH++A,加NaA晶体,A离子浓度增大,平衡逆向进行,溶液中氢离子浓度减小,根据离子积常数不变可知,溶液的c(OH)增大,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】最近全国各地持续出现雾霾天气,其首要污染物是可吸入颗粒物PM2.5和氮、硫的氧化物(PM2.5直径接近2.5×10-6m,1纳米=10-9m),主要来源为工业废气、机动车尾气等。因此对PM2.5、SO2、NOx进行研究、处理意义重大。
(1) 下列关于PM2.5说法正确的是_______
a.PM2.5在空气中形成了胶体;
b.PM2.5表面积大,能吸附大量有毒、有害物质;
c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染
(2) 取PM2.5样本用蒸馏水处理制得试样,若测得该试样所含水溶性无机离子及其平均
浓度如下表
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/ mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中的数据判断该试样的酸碱性为_______,其pH=______。
(3)对汽车尾气中的NOx进行研究
①NOx能形成酸雨,写出NO2转化为HNO3的化学方程式___________。
②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,已知下列热化学方程式:
ⅰ N2(g) +O2(g)![]() 2NO(g) △H=+180.5kJ·mol-1
2NO(g) △H=+180.5kJ·mol-1
ⅱ 2C(s)+ O2(g)![]() 2CO(g) △H =- 221.0 kJ·mol-1
2CO(g) △H =- 221.0 kJ·mol-1
ⅲ C(s)+ O2(g)![]() CO2( g) △H =- 393.5 kJ·mol-1
CO2( g) △H =- 393.5 kJ·mol-1
温度升高,反应ⅲ化学平衡常数_________。(填“增大”或“减小”或“不变”)
写出NO(g)和CO(g) 反应生成N2(g) CO2(g)的热化学方程式_______________。
(4)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等
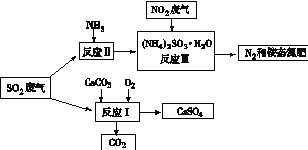
①写出反应Ⅰ的化学方程式:________________。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是___________。
③检验经过反应Ⅲ得到的氨态氮肥中SO42-所用试剂是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
①等物质的量浓度的两种溶液:NaHA溶液的pH________(填“大于”“小于”或“等于”)Na2A溶液的pH。NaHA溶液中存在_______个平衡。
②某温度下,若向0.1mol·L-1的NaHA溶液中逐滴滴加0.1mol·L-1 KOH溶液至溶液呈中性。此时该混合溶液中,下列关系中一定正确的是________。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)<c(K+)
D.c(Na+)+c(K+)=0.1mol·L-1
③已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
(2)已知:常温时CH3COOH![]() CH3COO-+H+,Ka=2×10-5则反应CH3COO-+H2O
CH3COO-+H+,Ka=2×10-5则反应CH3COO-+H2O![]() CH3COOH+OH-的平衡常数Kh=________。
CH3COOH+OH-的平衡常数Kh=________。
(3)常温下,若在0.10mol·L-1 CuSO4溶液中加入NaOH稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________mol·L-1{Ksp[Cu(OH)2]=2.2×10-20}。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1为CO2与CH4转化为CH3COOH的反应历程(中间体的能量关系如虚框中曲线所示),图2为室温下某溶液中CH3COOH和CH3COO-两种微粒浓度随pH变化的曲线。下列结论错误的是

A. CH4分子在催化剂表面会断开C—H键,断键会吸收能量
B. 中间体①的能量大于中间体②的能量
C. 室温下,CH3COOH的电离常数Ka=10-4.76
D. 升高温度,图2中两条曲线交点会向pH增大方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学可以变废为室,利用电解法处理烟道气中的NO,将其转化为NH4NO3的原理如下图所示,下列说法错误的是
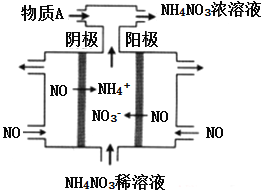
A. 该电解池的阳极反反为:NO-3e-+2H2O=NO3-+4H+
B. 该电解池的电极材料为多孔石墨,目的是提高NO的利用率和加快反应速率
C. 用NH4NO3的稀溶液代替水可以增强导电能力,有利于电解的顺利进行
D. 为使电解产物全部转化为NH4NO3,需补充物质A为HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由H、C、N、O、S等元素形成多种化合物在生产生活中有着重要应用。
I.化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g)△H1=-36kJ·mol-1
2CH4(g)+H2O(g)=CO(g)+3H2(g)△H2=+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,年生产lmolCO,转移电子的数目为______________________。
(2)甲醇催化脱氢可制得重要的化工产品一甲醛,制备过程中能量的转化关系如图所示。
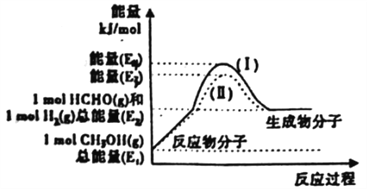
①写出上述反应的热化学方程式________________________________。
②反应热大小比较:过程I________过程II(填“大于”、“小于”或“等于”)。
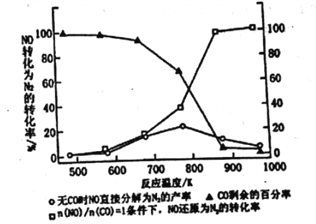
II.(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领城的重要课题。某研究性小组在实验室以Ag-ZSM-5为催化剂,删得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低。其可能的原因为_____________________________________,
在n(NO)/n(CO)=1的条件下,为更好的除去NOx物质,应控制的最佳温度在_______K左右。
(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式_________________________________________;
②若T1<T2
③上述反应T1℃时达到化学平衡后再通入0.1mol NO气体,则达到新化学平衡时NO的转化率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式____________。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15 390 | 21 771 |
则A原子的价电子排布式为______________。
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(Ⅰ)溶液来吸收原料气体中的CO(Ac—代表CH3COO—),其反应是:[Cu(NH3)2]Ac+CO+NH3![]() [Cu(NH3)3CO]Ac[醋酸羰基三氨合铜(Ⅰ)] ΔH<0。
[Cu(NH3)3CO]Ac[醋酸羰基三氨合铜(Ⅰ)] ΔH<0。
①C、N、O三种元素的第一电离能由小到大的顺序为____________。
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为____________。
③在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子和N原子轨道的杂化类型分别为________;1 mol尿素分子中,σ键的数目为________。
(4)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3 ℃,MgO的熔点高达2800 ℃。造成两种晶体熔点差距的主要原因是____________________________________。
(5)(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾。其中NH4+的空间构型是____________(用文字描述),与NO互为等电子体的分子是____________(填化学式)。
(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示Cu+,白色球表示Cl-),已知晶胞的棱长为a cm,则氯化亚铜密度的计算式为ρ=________g·cm-3(用NA表示阿伏加德罗常数)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积为 5L 的密闭容器中发生可逆反应:C(s)+H2O(g) ![]() CO(g)+H2(g)。
CO(g)+H2(g)。
(1)请写出该反应的化学平衡常数表达式 K= ________________________ 。
(2)不能判断该反应一定达到化学平衡状态的依据是_____________(填字母)
A.υ正(H2O)=υ逆(H2)
B.消耗 n mol H2 的同时消耗 n mol CO
C.容器中混合气体的密度不随时间而变化
D.混合气体的压强不再变化
(3)若在固定容积为 5L 的密闭容器中加入的是 2 mol Fe(s)与 1 mol H2O(g),发生反应: 3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g),△H<0,t1 秒时,H2 的物质的量为 0.2 mol,到 t2 秒时恰好达到平衡,此时 H2的物质的量为 0.35 mol。
Fe3O4(s)+4H2(g),△H<0,t1 秒时,H2 的物质的量为 0.2 mol,到 t2 秒时恰好达到平衡,此时 H2的物质的量为 0.35 mol。
①t1~t2这段时间内的反应速率υ(H2O)=____;达到平衡时,H2的体积分数为____。
②若继续加入 2 mol Fe(s),则平衡___________移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1molH2O再次达到平衡后,H2的物质的量为___________。
③该反应的逆反应速率随时间变化的关系如图:

t1时改变了某种条件,改变的条件可能是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀。根据上述实验事实,下列说法中,不正确的是
A.溶解度 MnS<PbS
B.MnS存在沉淀溶解平衡 MnS(s)![]() Mn2+(aq) + S2-(aq)
Mn2+(aq) + S2-(aq)
C.Cu2+转化为沉淀的原理为 MnS(s) + Cu2+(aq)=CuS(s) + Mn2+(aq)
D.沉淀转化能用于除去溶液中的某些杂质离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com