
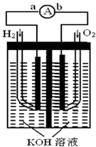
 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:分析 (1)负极上燃料失电子发生氧化反应,正极得电子发生还原反应;
(2)根据化合价的变化判断氧化剂和还原剂,根据氢气和转移电子之间的关系式计算.
解答 解:(1)该反应中负极上氢气失电子生成氢离子而被氧化,所以电极反应式为H2+2OH--2e-═2H2O,正极氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-故答案为:H2+2OH--2e-=2H2O,O2+2H2O+4e-=4OH-.
(2)①Ⅰ.2Li+H2$\frac{\underline{\;\;△\;\;}}{\;}$2LIH中锂失电子作还原剂,Ⅱ.LiH+H2O═LiOH+H2↑中水得电子作氧化剂,故答案为:Li;H2O;
②氢气的物质的量=$\frac{224L}{22.4L/mol}$=10mol,当吸收10molH2时,则生成20molLiH,20molLiH可生成20mol H2,实际参加反应的H2为20mol×80%=16mol,1molH2转化成1molH2O,转移2mol电子,所以16molH2可转移32mol的电子,故答案为:32;
点评 本题考查化学电源的工作原理及有关计算,题目难度较大,注意原电池电极反应式的书写以及从电子守恒的角度计算.


科目:高中化学 来源: 题型:解答题
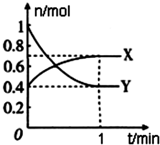 在一定温度下,体积为4L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.
在一定温度下,体积为4L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:庚烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 含氢量:甲烷>乙烯>乙炔>苯 | |
| C. | 密度:CCl4>CHCl3>苯>H2O | |
| D. | 同物质的量物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3中氮原子为sp2杂化,而CH4中碳原子是sp3杂化 | |
| B. | NH3中N原子形成三个杂化轨道,CH4中C原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 | |
| D. | NH3分子中有三个σ键,而甲烷分子中有四个σ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1 | B. | 0.3 mol•L-1 | C. | 0.02 mol•L-1 | D. | 0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白: NH3•H2O+H+.
NH3•H2O+H+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com