
| A. | NH3中氮原子为sp2杂化,而CH4中碳原子是sp3杂化 | |
| B. | NH3中N原子形成三个杂化轨道,CH4中C原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 | |
| D. | NH3分子中有三个σ键,而甲烷分子中有四个σ键 |
分析 NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,孤对电子对成键电子的排斥作用较强,氨气分子空间构型是三角锥形;CH4分子中C原子采取sp3型杂化杂化,杂化轨道全部用于成键,碳原子连接4个相同的原子,为正四面体构型.
解答 解:价层电子对数=σ 键个数+$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,氨气分子中,NH3中N原子成3个σ键,有一对未成键的孤对电子,价层电子对数=3+$\frac{1}{2}$(5-3×1)=4,所以采取sp3杂化,孤对电子对成键电子的排斥作用较强,N-H之间的键角小于109°28′,所以氨气分子空间构型是三角锥形;
CH4分子中C原子杂化轨道数=δ键数+孤对电子对数=4+0=4,所以采取sp3杂化,杂化轨道全部用于成键,碳原子连接4个相同的原子,C-H之间的键角相等为109°28′,故CH4为正四面体构型,
故选C.
点评 本题考查了分子空间构型的判断,注意理解价层电子对互斥理论与杂化轨道理论,题目难度中等.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:解答题
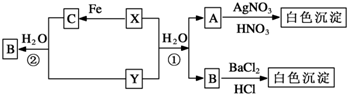
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥ | B. | ①③⑥ | C. | ①④⑤ | D. | ②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
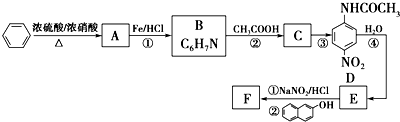
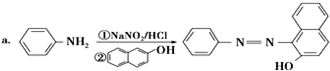
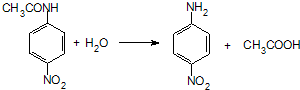 .
.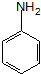 ;设计反应②和④的目的是保护氨基不被氧化.
;设计反应②和④的目的是保护氨基不被氧化.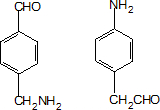 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
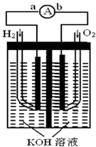 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C和14C互为同位素 | |
| B. | 乙醇与二甲醚(CH3-O-CH3)互为同分异构体 | |
| C. | H2O与D2O互为同位素 | |
| D. | 红磷与白磷互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
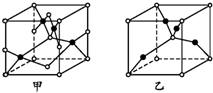 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态.
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com