
 ,D的电子排布式为1s22s22p63s23p2.
,D的电子排布式为1s22s22p63s23p2. .
.分析 p能级电子数不超过6,A原子最外层p能级的电子数等于次外层的电子数总数,则A的核外电子排布为1s22s22p2,应为C元素,B原子最外层中有两个不成对的电子,核外电子排布式为1s22s22p4,为O元素,B元素可分别与A、C、D、E生成RB2型化合物,且A、B、C属于同一周期,则C为N元素,可形成NO2化合物,在DB2和EB2中,D与B的质量比为7:8,则有M(D):M(O)=7:4,M(D)=7×$\frac{16}{4}$=28,D应为Si元素;E与B的质量比为1:1,则M(E)=2M(O)=2×16=32,所以E为S元素,
F为宇宙中含量丰富的元素,为H元素,
(1)N与H形成的常见化合物是氨气,氨气分子中N原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断氨气分子空间构型;
N元素原子核外有7个电子,根据构造原理书写N原子的电子排布图,D为Si元素,Si原子核外有14个电子,根据构造原理书写Si原子的电子排布式;
(2)A的氧化物为H2O,水分子中O原子价层电子对个数是4,根据价层电子对互斥理论判断中心原子轨道的杂化方式;
(3)A、B、C分别是C、O、N元素,同一周期元素,元素电负性随着原子序数增大而增大;
(4)SO2分子S原子价层电子对个数=2+$\frac{6-2×2}{2}$=3且含有一个孤电子对,孤电子对和成键电子对之间的排斥力大于成键电子对之间的排斥力.
解答 解:p能级电子数不超过6,A原子最外层p能级的电子数等于次外层的电子数总数,则A的核外电子排布为1s22s22p2,应为C元素,B原子最外层中有两个不成对的电子,核外电子排布式为1s22s22p4,为O元素,B元素可分别与A、C、D、E生成RB2型化合物,且A、B、C属于同一周期,则C为N元素,可形成NO2化合物,在DB2和EB2中,D与B的质量比为7:8,则有M(D):M(O)=7:4,M(D)=7×$\frac{16}{4}$=28,D应为Si元素;E与B的质量比为1:1,则M(E)=2M(O)=2×16=32,所以E为S元素,
F为宇宙中含量丰富的元素,为H元素,
(1)N与H形成的常见化合物是氨气,氨气分子中N原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断氨气分子空间构型为三角锥形;
N元素原子核外有7个电子,根据构造原理书写N原子的电子排布图为 ,D为Si元素,Si原子核外有14个电子,根据构造原理书写Si原子的电子排布式为1s22s22p63s23p2,
,D为Si元素,Si原子核外有14个电子,根据构造原理书写Si原子的电子排布式为1s22s22p63s23p2,
故答案为:三角锥形; ;1s22s22p63s23p2;
;1s22s22p63s23p2;
(2)A的氧化物为H2O,水分子中O原子价层电子对个数是4,根据价层电子对互斥理论判断中心原子轨道的杂化方式为sp3,电子式为 ,
,
故答案为:sp3; ;
;
(3)A、B、C分别是C、O、N元素,同一周期元素,元素电负性随着原子序数增大而增大,则这三种元素电负性大小顺序是O>N>C,故答案为:O>N>C;
(4)SO2分子S原子价层电子对个数=2+$\frac{6-2×2}{2}$=3且含有一个孤电子对,孤电子对和成键电子对之间的排斥力大于成键电子对之间的排斥力,所以S-O的键角<120o,
故答案为:<.
点评 本题考查位置结构性质相互关系及应用,为高频考点,涉及原子核外电子排布、微粒空间构型判断、原子杂化方式判断等知识点,侧重考查学生分析判断、计算及综合知识灵活运用能力,难点是价层电子对互斥理论的理解和掌握.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 证明氧化性:H2O2比Fe3+强 | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
| B | 鉴别溴蒸气和NO2 | 分别通入硝酸银溶液中,产生淡黄色沉淀的是溴蒸汽 |
| C | 证明盐类水解是吸热反应 | 在醋酸钠溶液中滴入酚酞试液,加热后红色加深 |
| D | 证明难溶物存在沉淀溶解平衡 | 往黄色固体难溶物PbI2加水中振荡,静置取上层清液加入 NaI固体产生黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷和氯气发生二氯取代反应,所得产物只有一种 | |
| B. | 糖类水解的最终产物一定是葡萄糖 | |
| C. | 淀粉和纤维素的组成都可以用(C6H10O5)n表示,所以它们既是同系物又是同分异构体 | |
| D. | 油脂是食物组成中的重要部分,也是产生能量最高的营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| C. | 汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率 | |
| D. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
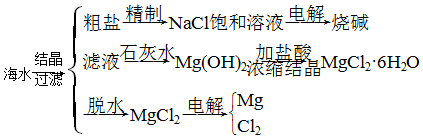
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
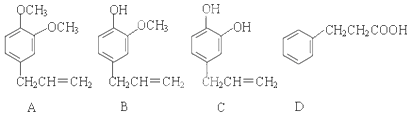

 ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com