
分析 (1)根据Q=$\frac{m}{M}$×△H计算判断;可以从氢气的性质和产物的性质方面分析氢气作燃料的优点.
(2)据盖斯定律解答;液氢、液氧恰好完全反应生成气态水,说明氢气和氧气按照物质的量2:1恰好反应,质量比为4:32,计算氢气质量,依据前面得到的热化学方程式计算放出的热量;
(3)根据燃料电池的工作原理:负极上是燃料发生失电子的氧化反应,正极上是氧气发生得电子的还原反应来回答.
解答 解:(1)设质量都为m,相同质量的H2、C、C8H18、CH4完全燃烧时,放出热量分别是$\frac{m}{2}$×285.8kJ、$\frac{m}{12}$×393.5kJ、$\frac{m}{114}$×5518kJ、$\frac{m}{16}$×890.3kJ,最大值应为$\frac{m}{2}$×285.8kJ;使用液氢作燃料的优点是:密度小、原料来源广泛、燃烧热值高、产物是水无污染等并且相同质量时,氢气放出的热量多,
故答案为:H2;产物为水,无污染,相同质量时,氢气放出的热量多;
(2)已知:①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
②H2(g)═H2(l)△H=-0.92kJ•mol-1
③O2(g)═O2(l)△H=-6.84kJ•mol-1
④H2O(l)═H2O(g)△H=+44.0kJ•mol-1
据盖斯定律,①-②×2-③+④×2得:2H2(l)+O2(l)=2H2O(g)△H=-546.92KJ/mol;
如果此次“阿特兰蒂斯号”所携带的燃料为45吨,液氢、液氧恰好完全反应生成气态水,氢气和氧气物质的量为2:1,质量比为4:32,45吨燃料中氢气的质量为$\frac{4}{32+4}$×45t=5吨,物质的量为2.5×106 mol,H2(l)+$\frac{1}{2}$O2(l)═H2O(g)△H=-237.46kJ/moL,故放出的热量为2.5×106×237.46=5.94×108 kJ,
故答案为:2H2(l)+O2(l)=2H2O(g)△H=-546.92KJ/mol;5.94×108;
(3)负极的反应中氢气失电子被氧化,氢气失电子生成氢离子,氢离子和溶液中的氢氧根离子生成水,所以电极反应式为2H2+4OH--4e-=4H2O;正极上是氧气得电子被还原,氧气得电子和水反应生成氢氧根离子,所以电极反应式为O2+2H2O+4e-=4OH-,总反应为2H2+O2=2H2O,
故答案为:2H2+4OH--4e-=4H2O;O2+2H2O+4e-=4OH-;2H2+O2=2H2O.
点评 本题考查学生有关电化学和热化学的综合知识,注意知识的迁移和应用是解题的关键,难度不大.


科目:高中化学 来源: 题型:解答题
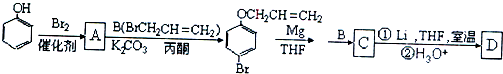
 、
、 .
. 是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有2种氢处于不同的化学环境.
是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有2种氢处于不同的化学环境. 的有机反应类型取代反应.
的有机反应类型取代反应. .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题.
钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 将乙醛加入含有新制银氨溶液的试管中,于沸水浴中加热来制得银镜 | |
| B. | 称量12.5gCuSO4•5H2O,配成100mL溶液,得到0.5mol/L的CuSO4溶液 | |
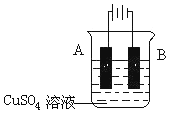
| C. | 用图1装置检验实验室制得的乙烯中混有SO2和CO2 | |
| D. | 利用图2装置从氯化铁溶液中直接蒸发结晶获得氯化铁晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三氧化二铁中有少量的氧化铝:加过量的烧碱溶液后过滤洗涤 | |
| B. | 氯化钠中有少量的I2:通过加热的方法 | |
| C. | CO中有少量的CO2:用氢氧化钠洗涤后再干燥 | |
| D. | 食盐中有少量的氧化铝:加过量的烧碱溶液后蒸发结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ag+、PO43-、Cl- | B. | Al3+、H+、I-、HCO3- | ||
| C. | K+、Na+、NO3-、MnO4- | D. | Al3+、Mg2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,D的电子排布式为1s22s22p63s23p2.
,D的电子排布式为1s22s22p63s23p2. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 任意比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 试剂(或条件) | |
| A | 温度对H2O2分解反应速率的影响 | ①热水浴②冰水浴 |
| B | 用稀硫酸比较铝和铁的金属活动性 | ①铝粉 ②铁钉 |
| C | 用酸化的AgNO3溶液检验海水中Cl-能否蒸馏除去 | ①海水 ②蒸馏所得液体 |
| D | 用Na块检验乙醇分子存在不同于烃分子里的氢原子 | ①乙醇 ②煤油 |

| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com