
| A. | 5.04g | B. | 3.6g | C. | 6.48g | D. | 3.24g |
科目:高中化学 来源: 题型:选择题
| A. | 2.4 g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等 | |
| C. | 在标准状况下,22.4 L CH4与18 g H2O所含有电子数均为10NA | |
| D. | CO和N2为等电子体,22.4 L的CO气体与1 mol N2所含的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 容量瓶检漏的操作是:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,倒置,观察是否漏水 | |
| C. | 在分液漏斗中分离两种液体时,要先从下端放出密度较大的液体,关闭活塞,取另一只烧杯后打开活塞再放出密度较小的液体 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1<△H3 | B. | △H2>△H3 | C. | △H1+△H3=△H2 | D. | △H1+△H2>△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
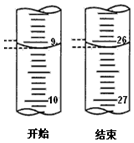 盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液能导电,所以NaOH溶液是电解质 | |
| B. | 固体KC1不导电,但KC1是电解质 | |
| C. | 氯水能导电,所以Cl2是电解质 | |
| D. | CO2的水溶液能导电,所以CO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| B. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 | |
| C. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| D. | 某溶液中先滴加少量BaCl2溶液,再滴加足量稀盐酸,生成白色沉淀,证明该溶液一定含有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com