
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 6.72L |
| 22.4L/mpl |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 4.48L |
| 22.4l/mol |
| 1 |
| 2 |
| 1 |
| 2 |


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
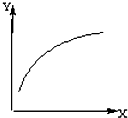 在密闭容器中加入A、B两种物质,在一定条件下反应:2A(s)+B(g)?2C(g) (△H<0).达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在密闭容器中加入A、B两种物质,在一定条件下反应:2A(s)+B(g)?2C(g) (△H<0).达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )| X | Y | |
| A | 再加入A | B的转化率 |
| B | 再加入B | C的体积分数 |
| C | 再加入C | B的体积分数 |
| D | 升高温度 | 混合气体密度 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含乙元素的化合物数目比含甲、丙元素的化合物数目多 |
| B、甲、丙元素最高价氧化物对应水化物的酸性强弱顺序为:甲<丙 |
| C、原子半径由大到小的顺序为丙>甲>乙 |
| D、乙元素的族序数比甲元素的族序数小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
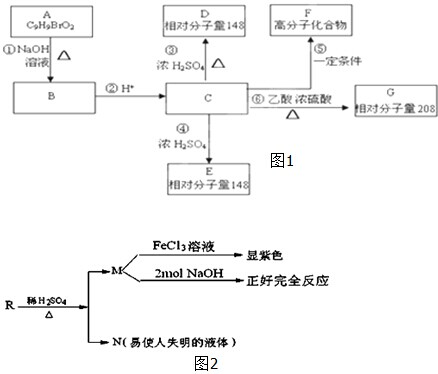
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅酸钠是钠盐,也是硅酸盐 |
| B、碳酸钠使无色酚酞试液变红,属于碱 |
| C、CO2溶于水能导电,属电解质 |
| D、CO还原氧化铁获得铁,属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com