
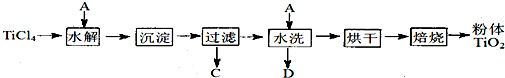
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
⑴TiCl4水解生成TiO2·xH2O的化学方程式为_______________________。
⑵检验TiO2·xH2O中Cl-是否被除净的方法是______________________________。
⑶滴定终点的现象是__________________________。
⑷滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为________________________。
⑸判断下列操作对TiO2质量分数测定结果的影响(填偏高、偏低或无影响)
① 若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果_______。
② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| cVM |
| 1000w |
| cVM |
| 10w |
| cVM |
| 1000w |
| cVM |
| 10w |
查看答案和解析>>
科目:高中化学 来源: 题型:

| cVM |
| 1000W |
| cVM |
| 10W |
| cVM |
| 1000W |
| cVM |
| 10W |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 TiO2?xH2O↓+4HCl
TiO2?xH2O↓+4HCl TiO2?xH2O↓+4HCl
TiO2?xH2O↓+4HCl
| cVM |
| 1000w |
| cVM |
| 10w |
| cVM |
| 1000w |
| cVM |
| 10w |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省高三下学期回头考试(理综)化学部分 题型:填空题
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(1)工业上二氧化钛的制备是: 资料卡片:
物质熔点SiCl4 -70 ℃ 、 TiCl4 -25 ℃;物质沸点SiCl457.6 ℃、TiCl4136.5 ℃
Ⅰ.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
Ⅱ.将SiCl4分离,得到纯净的TiCl4。
Ⅲ.在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
Ⅳ.经过滤、水洗除去其中的Cl—,再烘干、焙烧除去水分得到粉体TiO2 。
①在常温下分离TiCl4与SiCl4所采取的操作名称是 ;
②Ⅲ中反应的化学方程式是 ;
③ 检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
(2)TiO2粒子的大小可以用现代分析仪器测定,而用氧化还原滴定法可测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。回答下列问题:
①下列可用于测定TiO2粒子大小的方法是_____________________(填字母代号)。
a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
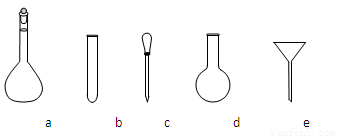
②配制NH4Fe(SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的_____(填字母代号)。
③滴定终点的现象是___________________________________________________。
④滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
⑤若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,对TiO2质量分数测定结果的影响_________________________。(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com