

 .
.分析 由元素在周期表中的位置可知,①为H元素,②为Na元素,④为C元素,⑤为N元素,⑥为O元素,③为Al,⑦为Cl元素.
(1)若E为氧化物,根据转化关系以及元素种类可知,则A为NO2,B为硝酸,
①硝酸与碳酸盐反应生成22个电子的二氧化碳分子,碳酸根水解使X溶液呈碱性;
②X为金属单质时,由转化图可知,应为Fe与稀硝酸反应生成硝酸铁;铁离子遇KSCN溶液变为血红色;
(2)根据转化关系以及元素种类可知,若E为单质气体,则E为氢气或氧气,A为Na或Na2O2等,B为NaOH,D为白色沉淀,D为Al(OH)3,由B$\stackrel{X}{→}$C$\stackrel{X}{→}$D,可以推知X为铝盐,C为偏铝酸盐.
解答 解:由元素在周期表中的位置可知,①为H元素,②为Na元素,④为C元素,⑤为N元素,⑥为O元素,③为Al,⑦为Cl元素.
(1)若E为氧化物,根据转化关系以及元素种类可知,则A为NO2,B为硝酸,NO2与水反应生成硝酸和一氧化氮,其反应为3NO2+H2O═2HNO3+NO.该反应中氧化剂是NO2,还原剂是NO2,氧化剂与还原剂的物质的量之比为1:2,
故答案为:3NO2+H2O═2HNO3+NO;1:2;
①C 分子中有 22 个电子时,C为二氧化碳,X为碳酸盐,硝酸与碳酸盐反应生成二氧化碳,CO32-离子水解CO32-+H2O?HCO3-+OH-使X液呈碱性,二氧化碳与碳酸钠反应生成D为NaHCO3,
故答案为:NaHCO3;
②X为金属单质时,由转化图可知,应为Fe与稀硝酸反应生成硝酸铁,X与B的稀溶液反应生成C的离子方程式为Fe+4H++NO3-═Fe3++NO↑+2H2O,检验生成物 C 的阳离子所用试剂为KSCN,电子式为 ,
,
故答案为:Fe+4H++NO3-═Fe3++NO↑+2H2O; ;
;
(2)由转化关系以及元素种类,若E为单质气体,则E为氢气或氧气,A为Na或Na2O2等,B为NaOH,D为白色沉淀,D为Al(OH)3,由B$\stackrel{X}{→}$C$\stackrel{X}{→}$D,可以推知X为铝盐[AlCl3 或 Al(NO3)3],C为偏铝酸盐,C与X反应的离子反应为3AlO2-+Al3++6H2O═4Al(OH)3↓,
故答案为:Na、Na2O2等;AlCl3 或 Al(NO3)3.
点评 本题考查无机物的推断及位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与推断、应用能力的考查,注意元素化合物知识的应用,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 比较钠和镁分别与冷水反应,判断金属活动性强弱 | |
| B. | 在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属活动性强弱 | |
| C. | SiH4在空气中可以自燃,而HCl不能燃烧,判断硅和氯的非金属性强弱 | |
| D. | 比较Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-+CO32-+2H+═HCO3-+H2O | B. | 2OH-+CO32-+3H+═HCO3-+2H2O | ||
| C. | OH-+CO32-+3H+═CO2↑+2H2O | D. | 2OH-+CO32-+4H+═CO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c的原子半径是这些元素中最大的 | |
| B. | b与其他三种元素均可形成至少两种二元化合物 | |
| C. | a与其他三种元素形成的二元化合物中其化合价均为+1 | |
| D. | d和a形成的化合物的溶液呈弱酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新方法利用的是化学变化,旧方法利用的是物理变化 | |
| B. | 反应②中既有旧化学键的断裂又有新化学键的形成 | |
| C. | 在反应①中每生成 12g 金刚石需要消耗 46g 金属钠 | |
| D. | 反应①和反应②中所得的金刚石都是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
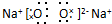 ,甲中的化学键类型为离子键、共价键.
,甲中的化学键类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
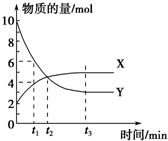 一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为5Y?X | B. | t1时,Y的浓度是X浓度的2倍 | ||
| C. | t2时,正、逆反应速率相等 | D. | t3时,正、逆反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g氧气(O2)和32g臭氧(O3)所含氧原子数都为2NA | |
| B. | 18g水中所含电子数为8NA | |
| C. | 常温常压下,1 mol氖气原子数为2NA | |
| D. | 常温常压下,111.2L氮气所含氮原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
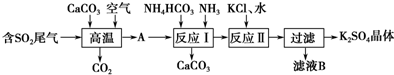
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com