
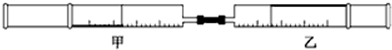
| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 乙针筒里的现象 |
| A | H2S | CuSO4溶液 | 产生黑色沉淀 |
| B | H2S | FeSO4溶液 | 产生黑色沉淀 |
| C | SO2 | H2S | 出现淡黄色固体 |
| D | SO2 | 紫色石蕊溶液 | 先变红后褪色 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:阅读理解

| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
| 1 | 40mL HCl | 40mL NH3 | 产生白烟 |
| 2 | 40mL Cl2 | 10mL水 | 剩余气体为20mL |
| 3 | 30mL NO | 15mL O2 | |
| 4 | 20mL AlCl3溶液 | 10mL NaOH溶液 | 生成白色沉淀,后消失 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 3 |
| 1 |
| 3 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| Cu |
| △ |
| Cu |
| △ |
| Cu |
| △ |
| Cu |
| △ |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
| 1 | 40mL HC1 | 40mL NH3 | 产生白烟 |
| 2 | 40mL Cl2 | 10mL水 | 剩余气体为20mL |
| 3 | 30mL NO | 15mL O2 | |
| 4 | 20mL AlCl3溶液 | 10mL NaOH溶液 | 生成白色沉淀,后消失 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
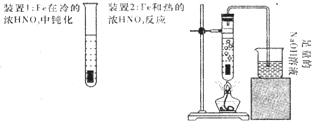
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com