
| A. | 按系统命名法,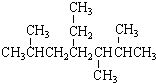 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 相同质量的烃,完全燃烧,消耗O2越多,烃中含ω(H)越高 | |
| D. | 乙烯和甲烷可用溴的四氯化碳溶液鉴别 |
分析 A.该命名没有满足取代基的编号之和最小原则,说明编号的方向错误;
B.烷烃中碳原子数相同时,分子中含有的支链越多,沸点越低;
C.烃类中,含氢量越高,等质量的烃燃烧时消耗的氧气越多;
D.根据乙烯和甲烷的化学性质进行解答.
解答 解:A.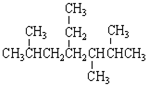 2,5,6-三甲基-4-乙基庚烷,该命名的编号方向错误,应该从右边开始编号,在2、3、6号C各含有1个甲基,在4号C含有1个乙基,该有机物正确命名为:2,3,6-三甲基-4-乙基庚烷,故A错误;
2,5,6-三甲基-4-乙基庚烷,该命名的编号方向错误,应该从右边开始编号,在2、3、6号C各含有1个甲基,在4号C含有1个乙基,该有机物正确命名为:2,3,6-三甲基-4-乙基庚烷,故A错误;
B.常压下,正戊烷、异戊烷、新戊烷的支链逐渐增多,其沸点依次减小,故B错误;
C.根据关系式C~2O2、2H2~O2可知,等质量的C、H元素,氢元素消耗的氧气多,所以等质量的烃,完全燃烧,消耗O2越多,烃中含氢量越高,故C正确;
D.乙烯能够与溴水发生加成反应而使溴水褪色,而甲烷不与溴水反应,可以用溴的四氯化碳鉴别乙烯和甲烷,故D正确.
故选CD.
点评 本题考查了有机物的命名、有机物结构与性质、有机物的鉴别等知识,题目难度中等,注意掌握常见有机物的结构与性质,明确常见有机物的鉴别方法.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题

| A. | 通电时阴极附近溶液的酸性增强 | |
| B. | 铅蓄电池的A极为正极 | |
| C. | 通电时,H+由左至右通过质子交换膜 | |
| D. | 通电时,Pt电极的质量几乎不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaHCO3═Na++H++CO32- | B. | H2SO4═2H++SO42- | ||
| C. | FeCl3═Fe3++Cl3- | D. | Ba(OH)2═Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
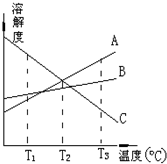
| A. | T3℃时,由A物质所形成的溶液的物质的量浓度最大 | |
| B. | T2℃时,由A、C两物质形成的溶液质量分数相等 | |
| C. | T1℃时,由B物质所形成的溶液质量分数最大,C的最小 | |
| D. | 从溶解度曲线可知分离A、C的混合溶液得到A可采用蒸发结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 | B. | 1mol•L-1 | C. | 3mol•L-1 | D. | 1.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
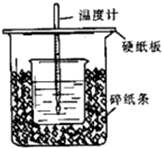 用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 原因 | 结论 |
| A | 铁比铜活泼 | 铜板上的铁钉在潮湿空气中容易生锈 |
| B | 汽油和植物油都属于烃 | 汽油和植物油都可以用作车用燃料 |
| C | 硅是良好的半导体材料 | 硅可用于制备光导纤维 |
| D | 淀粉 和蛋白质都是高分子化合物 | 淀粉和蛋白质都可水解生成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com