
����Ŀ��ʵ�����Ʊ��������ķ�Ӧԭ����ʵ��װ��(����װ����)���£�![]() +HO��NO2
+HO��NO2![]()
![]() +H2O
+H2O
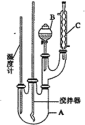
�����й�˵����ȷ����
A.��Ӧ��������ȴ�����µ����Һ©���С�������ˮ��5%��NaOH��Һ��ˮϴ�ӣ�Ȼ�����CaCl2������ˣ��ɵõ��ߴ��ȵ���������
B.�ñ�������Ҳ�����Ʊ��屽
C.װ��C��������������������������ˮ��C���¿�����
D.����������������ɫ�ģ���ʵ�������������ʻ�ɫ����Ҫ�������ܽ��˱�
���𰸡�B
��������
Aװ���з�������������Ũ�����������������·�����Ӧ������������ˮ��B��ʢ����ȴ���Ũ����Ũ�������ᣬ�μ���A�У��������ᷢ��ȡ����Ӧ�õ���������ˮ��cΪ�����ܣ���������������������ȴ�����µ����Һ©���С�������ˮ��5%��NaOH��Һ��ˮϴ�ӣ�Ȼ����������ƿ����ȥCaCl2�������������ռ�205��210����֣��õ������������ݴ˷�����
A������ˮϴ��ȥŨ���ᡢ���ᣬ�����������Ƴ�ȥ�ܽ�������ᣬ���ˮϴ��ȥδ��Ӧ��NaOH�����ɵ��Σ�Ȼ����������ƿ����ȥCaCl2�������������ռ�205��210����֣��õ�������������A����
B���屽�����ñ���Һ�������廯���Ĵ������·���ȡ����Ӧ�����屽���廯�⣬�ñ�������Ҳ�����Ʊ��屽����B��ȷ��
C��װ��C�����������ܣ�����������������������������ˮ��C���¿����룬�Ͽ���������C����
D���������ʻ�ɫ����Ҫ������������Ũ���ᣬŨ���������ֽ⣬����Ũ����ֽ������NO2(������)�����ʶ��ʻ�ɫ���������ܽ��˱�����D����
��ѡB��


 ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϸߴ������ͨ�����з�Ӧ��ȡ��SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)-236kJ�����������գ�
Si(s)+4HCl(g)-236kJ�����������գ�
��1����һ���¶��½���������Ӧ������Ӧ�������ݻ�Ϊ 2L���� 3min ��ﵽƽ�⣬��ù�������� 8.4 g������ H2 ��ʾ��ƽ����Ӧ����Ϊ_________��
��2���÷�Ӧ��ƽ�ⳣ������ʽ K=_________������ʹ K ���ɲ�ȡ�Ĵ�ʩ��_________��
��3��һ�������£����ܱպ��������У��ܱ�ʾ������Ӧһ���ﵽ��ѧƽ��״̬����_________��
a.2v �棨SiCl4��=v ����H2�� b.�Ͽ� 4mol Si-Cl ����ͬʱ������ 4mol H-Cl ��
c����������ܶȱ��ֲ��� d��c��SiCl4����c��H2����c��HCl��=1��2��4
��4������Ӧ������ͼ��ʾ���������ʾ�������Ȼ�������ʵ�����mol�����������ʾʱ�䣨min������������Ӧ����û�м������ȡ�����ʣ���� 1.5 ����v(��) ____ v(��)(��><��=)���� 3 ���Ӹı��������_______����ƽ��̬������ת������С��ʱ�����_______��
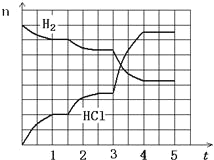
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ�����CO2��NH3�ϳ�����[CO(NH2)2]���ÿ��淴Ӧ���������У����������е������仯��ͼ��ʾ������˵��������ǣ� ��
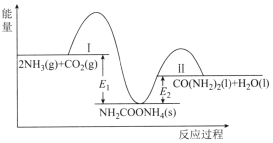
A.NH2COONH4Ϊ�ϳ����ط�Ӧ���м����
B.��Ӧ���淴Ӧ�Ļ�ܣ���Ӧ������Ӧ�Ļ��
C.��Ӧ��������ѧ�Ͻ������ƺܴ�
D.2NH3(g)+CO2(g)![]() CO(NH2)2(1)+H2O(1)���ʱ��H=El-E2
CO(NH2)2(1)+H2O(1)���ʱ��H=El-E2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ������A��M��һ�������µ�ת����ϵ�����ֲ��P��Ӧ����δ�г��������У� I ���ɵ�������Ԫ����ɵĵ����У��۵���ߵĽ�����K��һ�ֺ���ɫ���塣
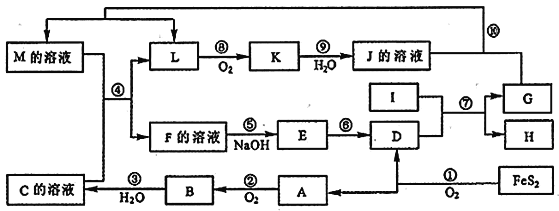
��ش���������
��1��M��F��E��G ��������������ͬһ��Ԫ�أ���������_____________��
��2��д����Ӧ�⣨��Һ J + G�������ӷ�Ӧ����ʽ__________________________________��
��3����Ӧ���б���ԭ�����Ӻͱ����������ӵ����ʵ���֮����___________��
��4����M����Һ��ֱ�ӵμ� NaOH ��Һ��������______________________��д����Ӧ�Ļ�ѧ����ʽ_____________________________��_______________________________��
��5���������� D �� KNO3��KOH ���ڣ����Ƶ�һ������ɫ��������Ч��ˮ�� K2FeO4��������أ���ͬʱ������ KNO2 �� H2O ���÷�Ӧ�ĵĻ�ѧ����ʽ��___________________________��
��6������120 t ������FeS2�����뷴Ӧ��ұ��������D�����յõ�������D��16 t����ұ��D��ת����Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ�ǹ㷺Ӧ�������������Ԫ�������úϽ�ij����С���ij�Ͼ���ͭԪ��(��25%BeO��71%CuS������FeS��SiO2)�л������ͭ���ֽ����Ĺ����������£�
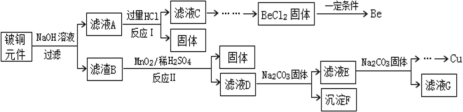
��֪��I���롢��Ԫ�ػ�ѧ�������ƣ�BeCl2����ʱ�������룻
���������²�����������ܶȻ��������±���
������ | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
�ܶȻ�����(Ksp) | 2.2��10��20 | 4.0��10��38 | 2.1��10��13 |
(1)��ҺA����Ҫ�ɷֳ�NaOH�⣬����___________(�ѧʽ)��д����ӦI�к��뻯������������ᷴӦ�����ӷ���ʽ��__________��
(2)����ҺC�к�NaCl��BeCl2������HCl��Ϊ�ᴿBeCl2���������ʵ�鲽��˳��Ϊ_______(����ĸ)
a.��������İ�ˮ b.ͨ�������CO2 c.���������NaOH d.����������HCl e.ϴ�� f.����
�ڴ�BeCl2��Һ�л��BeCl2�ľ����״��ᾧˮ�����ǽ�BeCl2������SOCl2(��ˮ�⣬����֮һ��ʹƷ����ɫ)��Ͽɵ���ˮBeCl2�����ƽ���ƶ��ǶȽ���ԭ��__________��
(3)MnO2�ܽ����������е���Ԫ������Ϊ���ʣ�д����Ӧ����CuS������Ӧ�Ļ�ѧ����ʽ��______��
(4)��ҺD��c(Cu2+)=2.2mol��L-1��c(Fe3+)=0.0080mol��L-1��c(Mn2+)=0.010mol��L-1������ͨ��������pH�ɽ������η���(����仯���Բ���)����Cu2+ǡ����ȫ����(c(Cu2+)=1.0��10-5 mol��L-1)ʱ����Һ��c(Cu2+)/ c(Fe3+)ԼΪ______��(![]() ��4.7��������λ��Ч����)
��4.7��������λ��Ч����)
(5)���NaCl��BeCl2������ο��Ʊ������롣
�ٵ������У������Ȼ��Ƶ�Ŀ����________��
�ڵ��õ���Be������Լ��1%��Na������ȥBe������Na�ķ���Ϊ________����֪�������ʵ��۷е����±���
���� | �۵�(K) | �е�(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(H3PO2��һԪ����)�ͷ�����(HBF4)��������ֲ��ɱ��������ʱ����1 mol L-1��H3PO2��Һ��1 mol�BL-1��HBF4��Һ��������ʼʱ�������ΪV0���ֱ�������Һ�м�ˮ��ϡ�ͺ���Һ�������ΪV������Һ��pH�仯������ͼ��ʾ.����˵��������ǣ�
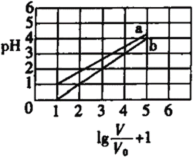
A.�����£���HBF4��Һ����pH=![]()
B.�����£�H3PO2�ĵ���ƽ�ⳣ��ԼΪ1.1![]() 10-2
10-2
C.�����£�NaBF4��Һ��pH=7
D.NaH2PO2��Һ�У�c(OH-)-c(H+) =c(H3PO2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�ĸ�ͼ�У���ʾ2A(g)+B(g)2C(g)����H��0��������淴Ӧ����ȷͼ��Ϊ��ע��(C)��ʾC������������P��ʾ����ѹǿ��C��ʾŨ�ȣ�
A. B.
B.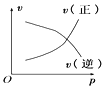 C.
C.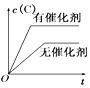 D.
D.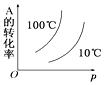
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�Ӧ6NO2��8NH3��7N2��12H2O���ɵ�صķ���������ʵ����Ч��������������ŷţ����ỷ����Ⱦ�����ܳ�����û�ѧ�ܣ�װ����ͼ��ʾ��

����˵������ȷ����
A. �������Ҳ�缫�������غ��������缫
B. Ϊʹ��س����ŵ磬���ӽ���Ĥ��ѡ�������ӽ���Ĥ
C. �缫A����ӦʽΪ��2NH3��6e����N2��6H��
D. ����4.48LNO2(��״��) ������ʱ��ת�Ƶ���Ϊ0.8mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Cu��Fe2O3�Ļ�����м���400 mL 1 mol��L��1�����ᣬǡ��ʹ�������ȫ�ܽ⣬������Һ�в���Fe3�������ù�����CO�ڸ����»�ԭ��ͬ������ԭ����������ٵ�����Ϊ
A. 2.4 g B. 3.2 g C. 4.8 g D. 6.4 g
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com