
【题目】下图是无机物A到M在一定条件下的转化关系(部分产物及反应条件未列出)。其中, I 是由第三周期元素组成的单质中,熔点最高的金属。K是一种红棕色气体。
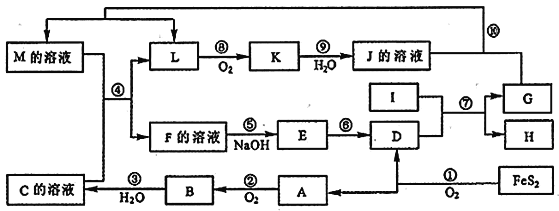
请回答下列问题
(1)M、F、E、G 四种物质中所含同一种元素,其名称是_____________。
(2)写出反应⑩(溶液 J + G)的离子反应方程式__________________________________。
(3)反应④中被还原的离子和被氧化的离子的物质的量之比是___________。
(4)向M的溶液中直接滴加 NaOH 溶液,现象是______________________,写出相应的化学方程式_____________________________,_______________________________。
(5)将化合物 D 与 KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂 K2FeO4(高铁酸钾),同时还生成 KNO2 和 H2O 。该反应的的化学方程式是___________________________。
(6)共有120 t 硫铁矿(FeS2)参与反应①冶炼化合物D,最终得到化合物D共16 t,则冶炼D的转化率为_____。
【答案】铁 3Fe + 8H+ + 2NO3 = 3Fe2+ + 2NO↑+ 4H2O 1:3 先产生白色沉淀,很快变为灰绿色,最终变成红褐色 Fe(NO3)2 + 2 NaOH = Fe(OH)2↓+ 2NaNO3 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 Fe2O3 +3KNO3 + 4KOH ![]() 2K2FeO4 + 3KNO2 + 2H2O 20%
2K2FeO4 + 3KNO2 + 2H2O 20%
【解析】
FeS2氧化得到二氧化硫和氧化铁,A可以继续被氧化,则A为SO2,B为SO3,C为H2SO4,D为Fe2O3;I为第三周期中熔点最高的金属单质,I为Al,则反应⑦为铝单质与氧化铁发生的铝热反应,得到Fe与氧化铝;K是一种红棕色气体,则K为NO2,J为HNO3,J与G反应得到L,L被氧化成为NO2,则G为Fe,H为Al2O3,L为NO,联系反应④:M+H2SO4 →F+NO知,M为Fe(NO3)2,F为铁盐溶液,E为Fe(OH)3,据此分析解答。
FeS2氧化得到二氧化硫和氧化铁,A可以继续被氧化,则A为SO2,B为SO3,C为H2SO4,D为Fe2O3;I为第三周期中熔点最高的金属单质,I为Al,则反应⑦为铝单质与氧化铁发生的铝热反应,得到Fe与氧化铝;K是一种红棕色气体,则K为NO2,J为HNO3,J与G反应得到L,L被氧化成为NO2,则G为Fe,H为Al2O3,L为NO,联系反应④:M+H2SO4 →F+NO知,M为Fe(NO3)2,F为铁盐溶液,E为Fe(OH)3。
(1)M、F、E、G 四种物质中所含同一种元素,为Fe,其名称是铁,故答案为:铁;
(2)反应⑩为铁与硝酸反应生成硝酸亚铁和一氧化氮,反应的离子反应方程式为3Fe + 8H+ + 2NO3 = 3Fe2+ + 2NO↑+ 4H2O,故答案为:3Fe + 8H+ + 2NO3 = 3Fe2+ + 2NO↑+ 4H2O;
(3)反应④为硝酸亚铁与硫酸发生的氧化还原反应,反应中被还原的离子为硝酸根离子,反应生成NO,转移3个电子,被氧化的离子为亚铁离子,反应生成铁离子,转移1个电子,根据得失电子守恒,被还原的硝酸根离子和被氧化的亚铁离子的物质的量之比是1∶3,故答案为:1∶3;
(4)向M(硝酸亚铁)的溶液中直接滴加 NaOH 溶液,可以看到的现象为先产生白色沉淀,很快变为灰绿色,最终变成红褐色,相应的化学方程式有Fe(NO3)2 + 2 NaOH = Fe(OH)2↓+ 2NaNO3、4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3,故答案为:先产生白色沉淀,很快变为灰绿色,最终变成红褐色;Fe(NO3)2 + 2 NaOH = Fe(OH)2↓+ 2NaNO3;4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3;
(5)化合物Fe2O3与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O,反应的化学方程式为:Fe2O3+3KNO3+4KOH ![]() 2K2FeO4+3KNO2+2H2O,故答案为:Fe2O3+3KNO3+4KOH
2K2FeO4+3KNO2+2H2O,故答案为:Fe2O3+3KNO3+4KOH ![]() 2K2FeO4+3KNO2+2H2O;
2K2FeO4+3KNO2+2H2O;
(6)120 t 硫铁矿(FeS2)中含有铁元素120 t×![]() =56t,完全转化为氧化铁能够生成氧化铁的质量为56t×
=56t,完全转化为氧化铁能够生成氧化铁的质量为56t×![]() =80t,因此冶炼氧化铁的转化率=
=80t,因此冶炼氧化铁的转化率=![]() ×100%=20%,故答案为:20%。
×100%=20%,故答案为:20%。


科目:高中化学 来源: 题型:
【题目】天然油脂结构的核心为甘油[HOCH2CH(OH)CH2OH],有一瘦身用的非天然油脂,其结构的核心则为蔗糖(C12H22O11)。该非天然油脂可由直链型的不饱和油酸(C17H33COOH)与蔗糖反应而得,其反应示意图如下图所示(注意:图中的反应式不完整)下列说法正确的是
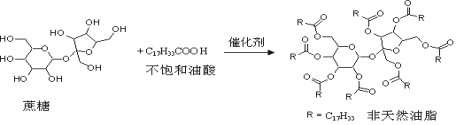
A. 蔗糖酯属于油脂类物质B. 非天然油脂为高分子化合物
C. 该非天然油脂与稀硫酸共热,其水解产物在常温下均为固态D. 该蔗糖酯在稀硫酸的作用下水解,最终可生成三种有机化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学需用480 mL 0.5 mol·L-1Na2CO3溶液,在实验室进行配制。
I.(1)该同学用托盘天平应称量________g Na2CO3粉末,使用容量瓶前必须进行的一步操作是______。
(2)下图是该同学配制的一些关键步骤和操作图。
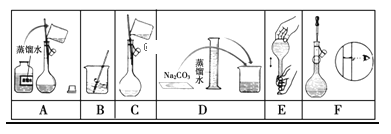
配制过程的先后顺序为(用字母A~F填写)________________。
Ⅱ.若配制1mol/L的稀硫酸溶液500mL
(1)则需要质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为___________mL(计算结果保留一位小数)。如果实验室有10mL 、25mL、50mL量筒,应选用_____________mL规格的量筒最好。
(2)下面操作造成所配稀硫酸溶液浓度偏高的是(_____)
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO![]() 完全沉淀;若加入足量强碱并加热(
完全沉淀;若加入足量强碱并加热(![]() ,假设氨气全部逸出)可得到c mol NH3,则原溶液中的Al3+浓度为
,假设氨气全部逸出)可得到c mol NH3,则原溶液中的Al3+浓度为
A.![]() mol/LB.
mol/LB.![]() mol/LC.
mol/LC.![]() mol/LD.
mol/LD.![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列5种离子中的某几种:![]() 。为确认溶液组成进行如下实验:
。为确认溶液组成进行如下实验:
(1)取1L上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀6.63g。向沉淀中加入过量的盐酸,有4.66g沉淀不溶。
(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体2.24L(已换算成标准状况,假定产生的气体全部逸出)。
已知:①![]() ②NH3是一种极易溶于水的碱性气体
②NH3是一种极易溶于水的碱性气体
由此可以得出关于原溶液组成的正确结论是
A.![]()
B.如果上述5种离子都存在,则![]()
C.一定存在![]() ,一定不存在K+
,一定不存在K+
D.一定存在![]() ,可能存在
,可能存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下几种有机物:
①CH4 ②CH3CH2OH ③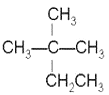 ④葵烷 ⑤CH3COOH ⑥
④葵烷 ⑤CH3COOH ⑥![]()
⑦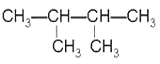 ⑧
⑧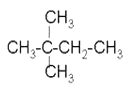 ⑨丙烷
⑨丙烷
请利用上述给出的物质按要求回答下列问题:
(1)相对分子质量为44的烷烃的结构简式为______________;
(2)分子中含有14个氢原子的烷烃的分子式是__________;
(3)与③互为同分异构体的是______________(填序号);
(4)用“>”表示①③④⑨熔沸点高低顺序:_________________(填序号);
(5)在120℃,1.01×105Pa条件下,某种气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,则该烃是______(填序号);它与⑧互为_________________关系;
(6)有机物⑤和②在一定条件下发生反应的化学方程式是______________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
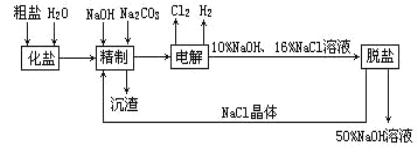
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生的电极反应式为_______;与电源负极相连的电极附近,溶液pH______(选填:不变、升高或下降)。
(2)如果粗盐中SO42-含量较高,必须加钡剂除去,该钡试剂可以是______
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(3)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为______、_______
(4)电解饱和食盐水的总反应化学方程式为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如下转化关系。(反应中生成的水已略去)
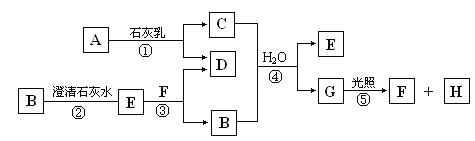
请回答以下问题:
(1)E是______(填化学式)。
(2)C物质在日常生活中可作______剂。
(3)写出反应④ 的化学方程式:____________。
(4)写出实验室制取A气体的化学反应方程式,并用双线桥表示电子转移的方向和数目:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型银-锌电池可用作电子仪器的电源,其电极分别是![]() 和
和![]() ,电解质
,电解质![]() 溶液,电池总反应为
溶液,电池总反应为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A. 电池工作过程中,![]() 溶液浓度降低
溶液浓度降低
B. 电池工作过程中,电解液中![]() 向正极迁移
向正极迁移
C. 负极发生反应![]()
D. 正极发生反应![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com