
【题目】已知制备胶体的反应原理为: FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl,现有甲、乙、丙三名同学分别进行制备Fe(OH)3胶体的实验
Fe(OH)3(胶体)+3HCl,现有甲、乙、丙三名同学分别进行制备Fe(OH)3胶体的实验
Ⅰ、甲同学直接加热饱和FeCl3溶液;
Ⅱ、乙同学向25 mL沸水中逐滴加入FeCl3饱和溶液;煮沸至液体呈红褐色,停止加热
Ⅲ、丙同学和乙同学一样,但是溶液出现红褐色后忘记停止,继续加热较长时间。
试回答下列问题:
(1)判断胶体制备是否成功,可利用胶体的__________________________,其中操作方法及现象是_____________________________________。
(2)Fe(OH)3胶体是不是电解质:_______________(填“是”或“不是”)。
(3)丁同学检查实验结果发现___________(填甲、乙或丙)的烧杯底部有沉淀。
(4)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①取部分胶体将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶体的胶粒带___________电荷。
②取部分胶体向其中逐滴滴加硫酸溶液,开始产生红褐色沉淀,这是因为_________;继续滴加,沉淀减少最终消失,写出化学反应方程式__________________。
③欲除去Fe(OH)3胶体中混有的NaCl溶液的操作名称是__________。
【答案】丁达尔效应 用一束光通过胶体,可以看到一条光亮的通路 不是 甲、丙 正 加电解质,胶体聚沉 2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O 渗析
【解析】
(1)胶体能产生丁达尔效应;
(2)Fe(OH)3胶体是混合物,电解质是纯净物;
(3)直接加热饱和FeCl3溶液,三价铁会水解生成红褐色沉淀;胶体持续加热发生聚沉;
(4)胶体粒子带电荷,通电后发生电泳;胶体中加入电解质发生聚沉,氢氧化铁与过量硫酸发生反应生成硫酸铁和水;胶体粒子不能透过半透膜,溶液能透过半透膜。
(1)胶体能产生丁达尔效应,判断胶体制备是否成功,可利用胶体的丁达尔效应,其中操作方法及现象是用一束光通过胶体,可以看到一条光亮的通路;
(2) 电解质是纯净物,Fe(OH)3胶体是混合物,所以Fe(OH)3胶体不是电解质;
(3)直接加热饱和FeCl3溶液,三价铁会水解生成红褐色沉淀;胶体持续加热发生聚沉,所以甲、丙的烧杯底部有沉淀;
(4)①取部分胶体将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,氢氧化铁胶体离子移向阴极,表明Fe(OH)3胶体的胶粒带正电荷;
②取部分胶体向其中逐滴滴加硫酸溶液,开始产生红褐色沉淀,这是因为加电解质,胶体聚沉;继续滴加,氢氧化铁与过量硫酸发生反应生成硫酸铁和水,沉淀减少最终消失,化学反应方程式是2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O;
③胶体粒子不能透过半透膜,溶液能透过半透膜,用渗析法除去Fe(OH)3胶体中混有的NaCl溶液。


科目:高中化学 来源: 题型:
【题目】已知NaClO2在水溶液中能发生水解。常温时,有1 mol/L的HClO2溶液和1mol/L的HBF4(氟硼酸)溶液起始时的体积均为V0,分别向两溶液中加水,稀释后溶液的体积为V,所得曲线如图所示。下列说法错误的是
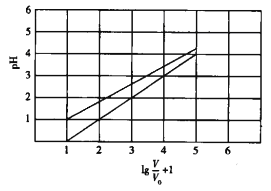
A. HClO2为弱酸,HBF4为强酸
B. 常温下HClO2的电高平衡常数的数量级为10—4
C. 在0≤pH≤5时,HBF4溶液满足pH=lg(V/V0)
D. 25℃时1L pH=2的HBF4溶液与100℃时1L pH=2的HBF4溶液消耗的NaOH相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中溴含量约为 65 mg·L-1,从海水中提取溴的工艺流程如下:

(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是____________。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的____。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:_____![]()
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:__________。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是____。
A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,并测得混合液的导电能力随时间变化曲线如图,该小组同学据图分析错误的是

A.AB段溶液的导电能力不断减弱,说明电解质逐渐转变为非电解质
B.B处的导电能力为0,说明溶液中几乎没有自由移动的离子
C.BC段溶液的导电能力不断增大,主要是由于过量的Ba(OH)2电离出的离子导电
D.a时刻Ba(OH)2溶液中与稀硫酸恰好完全中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计了一种智能双模式海水电池,满足水下航行器对高功率和长续航的需求。负极为Zn,正极放电原理如图。下列说法错误的是( )
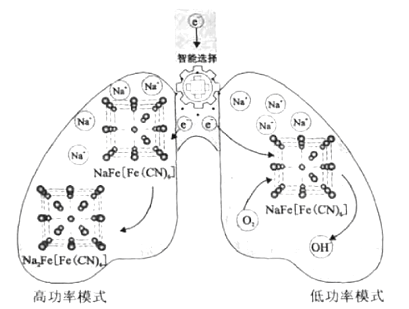
A. 电池以低功率模式工作时,NaFe[Fe(CN)6]作催化剂
B. 电池以低功率模式工作时,Na+的嵌入与脱嵌同时进行
C. 电池以高功率模式工作时,正极反应式为:NaFe[Fe(CN)6]+e-+Na+=Na2Fe[Fe(CN)6]
D. 若在无溶解氧的海水中,该电池仍能实现长续航的需求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是
A. 25 ℃时,向0.1 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH)>c(SO![]() )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
B. 25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol·L-1
C. 0.1![]()
![]() 溶液:
溶液:![]()
D. 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】UO2与铀氮化物是重要的核燃料,已知:3(NH4)4[UO2(CO3)3]![]() 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
回答下列问题:
(1)基态氮原子价电子排布图为______。
(2)反应所得气态化合物中属于非极性分子的是_______(填化学式)。
(3)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是________(填标号)。
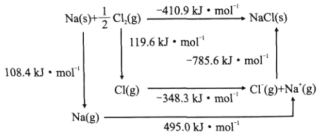
a.Cl-Cl键的键能为119.6kJ/mol b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol d.Cl的第一电子亲和能为348.3kJ/mol
(4)依据VSEPR理论推测CO32-的空间构型为_________。分子中的大丌键可用符号丌![]() 表示,其中m代表参与形成大丌键的原子数,n代表参与形成大丌键的电子数(如苯分子中的大丌键可表示为丌
表示,其中m代表参与形成大丌键的原子数,n代表参与形成大丌键的电子数(如苯分子中的大丌键可表示为丌![]() ),则CO32-中的大丌键应表示为_____
),则CO32-中的大丌键应表示为_____
(5)UO2可用于制备UF4:2UO2+5NH4HF2![]() 2UF4·2NH4F+3NH3↑+4H2O,其中HF2的结构表示为[F—H…F]-,反应中断裂的化学键有_______ (填标号)。
2UF4·2NH4F+3NH3↑+4H2O,其中HF2的结构表示为[F—H…F]-,反应中断裂的化学键有_______ (填标号)。
a.氢键 b.极性键 c.离子键 d.金属键 e.非极性键
(6)铀氮化物的某两种晶胞如图所示:
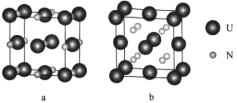
①晶胞a中铀元素的化合价为__________,与U距离相等且最近的U有_______个。
②已知晶胞b的密度为dg/cm3,U原子的半径为r1cm,N原子的半径为为r2cm,设NA为阿伏加德罗常数的值,则该晶胞的空间利用率为___________(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,两种碳酸盐![]() ,(
,(![]() 分别为Ca2+和Ba2+两种离子)的沉淀溶解平衡曲线如图所示。已知:
分别为Ca2+和Ba2+两种离子)的沉淀溶解平衡曲线如图所示。已知:![]() ,
,![]() 。已知
。已知![]() 比
比![]() 溶解度更大(不考虑阴离子的水解)。下列说法正确的是
溶解度更大(不考虑阴离子的水解)。下列说法正确的是
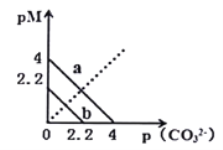
A. 向![]()
![]() 的
的![]() 溶液中加入固体
溶液中加入固体![]() ,当加入
,当加入![]() 固体的质量为
固体的质量为![]() 时,
时,![]() 恰好沉淀完全(离子浓度为
恰好沉淀完全(离子浓度为![]() 时认为沉淀完全;忽略溶液体积变化)
时认为沉淀完全;忽略溶液体积变化)
B. ![]() 的
的![]()
C. 该温度下,向![]() 的饱和溶液中加入
的饱和溶液中加入![]() 溶液,一定能产生沉淀
溶液,一定能产生沉淀
D. 线![]() 表示
表示![]() 的溶解平衡曲线
的溶解平衡曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA是强酸
B. 该混合液pH=7
C. 图中x表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com