
【题目】用下列装置进行相应实验,能达到实验目的的是( )
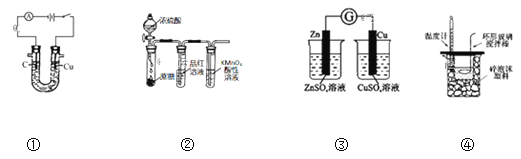
A.图①所示装置可电解食盐水制氯气和氢气
B.图②所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
C.图③装置可以用来验证化学能转化为电能
D.图④测定中和热
科目:高中化学 来源: 题型:
【题目】用KIO3与H2S反应制备KI固体,装置如图所示。实验步骤:①检查装置的气密性;②关闭K,在各装置中加入相应试剂,向装置B中滴入30%的KOH溶液,制得KIO3;③打开K,通入H2S直至饱和可制得KI,同时有黄色沉淀生成;④关闭K,向所得溶液滴入稀硫酸,水浴加热,充分逸出H2S;⑤把装置B中混合液倒入烧杯,为除去硫酸,加入足量碳酸钡,再经过一系列操作可得成品。下列有关该实验的叙述错误的是( )
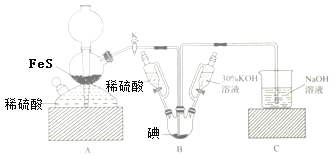
A.步骤②可观察到固体溶解,溶液由棕黄色变为无色
B.步骤③装置B中发生反应的离子方程式为3H2S+IO3-═3S↓+3H2O+I-
C.装置C中氢氧化钠溶液的作用是吸收硫化氢
D.步骤⑤中一系列操作为过滤,洗涤,合并滤液和洗液,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法正确的是( )

(注:铝土矿中含有![]() 、
、![]() 、
、![]() )
)
A.由铝土矿制备铝的过程中铝元素发生了氧化反应
B.石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C.在制粗硅的反应中,氧化剂与还原剂的物质的量之比为1∶2
D.黄铜矿![]() 与
与![]() 反应产生的
反应产生的![]() 、
、![]() 均只是还原产物
均只是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯水中存在多种分子和离子,可通过实验的方法加以确定,下列说法中错误的是( )
A. 加入含有NaOH的酚酞溶液,红色褪去,说明有H+存在
B. 加入有色布条后,有色布条退色,说明有HClO分子存在
C. 氯水呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在
D. 加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固定容积为1L的密闭容器中,1molA(g)与1molB(g)在催化剂作用下加热到500℃发生反应:A(g)+B(g)![]() C(g)+2D(s) ΔH>0,下列有关说法正确的是
C(g)+2D(s) ΔH>0,下列有关说法正确的是
A. 升高温度,![]() 增大,
增大,![]() 逆减小
逆减小
B. 平衡后再加入1molB,上述反应的ΔH增大
C. 通入稀有气体,压强增大,平衡向正反应方向移动
D. 若B的平衡转化率为50%,则该反应的平衡常数等于2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将2molSO2和1molO2冲入10L恒温密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g)ΔH═-196kJ/mol,5min时达到平衡,测得反应放热166.6kJ。下列说法错误的是( )
A.0~5min内,用O2表示的平均反应速率υ(O2)═0.017mol·(L·min)-1
B.条件不变,起始时向容器中冲入4molSO2和2molO2,平衡时反应放热小于333.2kJ
C.若增大O2的浓度,则SO2的转化率增大
D.![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把图2中的物质补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。

对该氧化还原反应的离子方程式,下列说法不正确的是
A. IO4-作氧化剂,具有氧化性 B. 氧化性: MnO4-> IO4-
C. 氧化剂和还原剂的物质的量之比为5 :2 D. 若有2molMn2+参加反应,则转移10mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】获取安全的饮用水成为人们关注的重要问题。回答下列问题:

(1)漂白粉常用于自来水消毒。工业上用氯气和石灰乳制取漂白粉的化学方程式为_________。实验室用MnO2与浓盐酸反应制备Cl2 的反应装置如图所示,制备实验开始时先检查装置气密性,接下来的操作依次是_____________________(填下列序号)。
①往烧瓶中加入浓盐酸 ②加热 ③往烧瓶中加入MnO2粉末
(2)聚铁[Fe2(OH)n(SO4)3-0.5n]m是一种高效无机水处理剂,制备原理是调节Fe2(SO4)3溶液的pH,促进其水解制取。用铁的氧化物制取聚铁的流程如下:
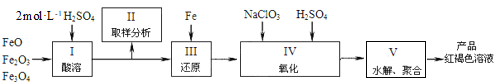
①实验室配制2mol·L-1的稀硫酸250mL需98%的浓硫酸(ρ=1.84g·mL-1)_______mL,配制过程中应使用的玻璃仪器有玻璃棒、烧杯、量筒、________________________。
②步骤Ⅳ中发生反应的离子方程式为_______________。
③步骤Ⅴ中需将溶液加热到70~80 ℃的目的是________________。Ⅴ中溶液的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的方法为_____________;若溶液的pH偏小,将导致聚铁中铁的质量分数__________(填“偏高”、“偏低”或“无影响”)。
(3)硬水易导致产生锅炉水垢[主要成分为CaCO3、Mg(OH)2、CaSO4],不仅会降低燃料的利用率,还会影响锅炉的使用寿命,造成安全隐患,因此要定期清除。清除时首先用饱和Na2CO3溶液浸泡水垢,发生CaSO4(s)+CO32-(aq) ![]() CaCO3(s)+SO42-(aq),该反应的平衡常数K =_______。然后再用醋酸溶解、水洗涤。已知:Ksp(CaSO4)=7.5×10-5、Ksp(CaCO3)=3.0×10-9。
CaCO3(s)+SO42-(aq),该反应的平衡常数K =_______。然后再用醋酸溶解、水洗涤。已知:Ksp(CaSO4)=7.5×10-5、Ksp(CaCO3)=3.0×10-9。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如下图所示,试回答:

(1)a点之前的反应的离子方程式为________________。
(2)a点到b点之间的反应的离子方程式是________________、________________。
(3)c点二氧化碳体积是________L。
(4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com