
����Ŀ��һ���¶��£���2molSO2��1molO2����10L�����ܱ������У�������Ӧ��2SO2(g)+O2(g) 2SO3(g)��H�T��196kJ/mol��5minʱ�ﵽƽ�⣬��÷�Ӧ����166.6kJ������˵��������ǣ� ��
A.0~5min�ڣ���O2��ʾ��ƽ����Ӧ������(O2)�T0.017mol��(L��min)-1
B.�������䣬��ʼʱ�������г���4molSO2��2molO2��ƽ��ʱ��Ӧ����С��333.2kJ
C.������O2��Ũ�ȣ���SO2��ת��������
D.![]() ��ֵ����ʱ���÷�Ӧ�ﵽƽ��״̬
��ֵ����ʱ���÷�Ӧ�ﵽƽ��״̬
���𰸡�B
��������
A�����ʵ��������������ȣ�5minʱ�ﵽƽ�⣬��÷�Ӧ����166.6kJ����μӷ�Ӧ������Ϊ![]() =0.85mol��0��5 min�ڣ���O2��ʾ��ƽ����Ӧ��������O2��=
=0.85mol��0��5 min�ڣ���O2��ʾ��ƽ����Ӧ��������O2��=![]() =0.017 mol��L-1��min-1����A��ȷ��
=0.017 mol��L-1��min-1����A��ȷ��
B. 2mol SO2��1mol O2����10L�����ܱ������дﵽƽ��ʱ����������Ϊ0.85mol���ų�����Ϊ166.6kJ�����������䣬��ʼ�������г���4 mol SO2��2 mol O2�����ʵ���Ϊԭ����2����ѹǿ����ƽ�������ƶ����ﵽƽ��ʱ������������0.85mol��2=1.7mol����ƽ��ʱ���ȴ���166.6kJ��2=333.2 kJ����B����
C. ������O2��Ũ�ȣ�ƽ�������ƶ�����SO2��ת��������C��ȷ��
D. �ﵽƽ��״̬�������Ũ�Ȳ��䣬���淴Ӧ������ȣ�![]() ��ֵ����ʱ����֪�����ʵ����ʵ������䣬��Ӧ�ﵽƽ�⣬��D��ȷ��
��ֵ����ʱ����֪�����ʵ����ʵ������䣬��Ӧ�ﵽƽ�⣬��D��ȷ��
��ѡB��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����
�� | ��������� | ������ | ������ | ���������� |
| __________ | ____________ | _________ | _________ |
| _________ | ___________ | _________ | ____________ |
| ___________ | ________ | ______ | ________ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() �Ǵ�����Ⱦ��֮һ��ʵ�����⽫
�Ǵ�����Ⱦ��֮һ��ʵ�����⽫![]() ��
��![]() �����
�����![]() ��Һ���յķ�����������Ⱦ���ش��������⣺
��Һ���յķ�����������Ⱦ���ش��������⣺
(1)�������Ʊ�
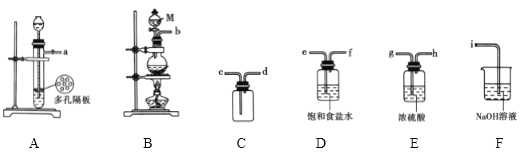
������M��������_______________
������![]() ��Ũ�����Ʊ����ռ�һƿ���������������ѡ����ͼ�е�װ�ã�������˳��Ϊ____________��������������Сд��ĸ��ʾ����
��Ũ�����Ʊ����ռ�һƿ���������������ѡ����ͼ�е�װ�ã�������˳��Ϊ____________��������������Сд��ĸ��ʾ����
��D���Ʊ�װ���е�������______________��װ��F��������__________________��
(2)������ͼ��ʾװ�ã�̽��![]() ��
��![]() ��
��![]() ��Һ�еķ�Ӧ�������й����Ͽ�֪��
��Һ�еķ�Ӧ�������й����Ͽ�֪��![]() ��һ�����ᣬ�Ҳ��ȶ����ֽ�����
��һ�����ᣬ�Ҳ��ȶ����ֽ�����![]() ��
��![]() ��
��
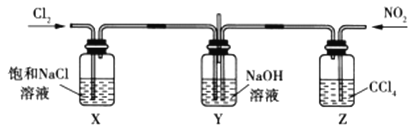
��װ����X��Z��������_______________
��ʵ��ʱ�۲쵽X�Լ�ƿ���л���ɫ���壬Z�Լ�ƿ���к���ɫ���壬��ͨ���ʵ�������![]() ��
��![]() ��Y�й۲첻��������ɫ����Ӧ���������ϡ������������Y�з�����Ӧ�Ļ�ѧ����ʽ��___________��
��Y�й۲첻��������ɫ����Ӧ���������ϡ������������Y�з�����Ӧ�Ļ�ѧ����ʽ��___________��
�۷�Ӧ������ȡY����Һ���������Թ��У�����ϡ���ᣬ���к���ɫ������������Ͳ����������ԭ��_____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں�Fe3+��S2O82����I���Ļ����Һ�У���ӦS2O82��(aq)+2I��(aq)=2SO42��(aq)+I2(aq)�ķֽ��������Ӧ�����е������仯���£�
�������2Fe3+(aq)+2I��(aq)=I2(aq)+2Fe2+(aq)
�������2Fe2+(aq)+S2O82��(aq)=2Fe3+(aq)+2SO42��(aq)
�����йظ÷�Ӧ��˵����ȷ����
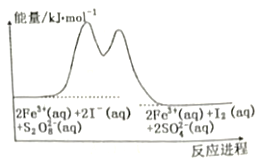
A. ��ѧ��Ӧ������Fe3+Ũ�ȵĴ�С�й�
B. �÷�ӦΪ���ȷ�Ӧ
C. Fe2+�Ǹ÷�Ӧ�Ĵ���
D. ������Fe3+��������Ӧ�Ļ�ܱ��淴Ӧ�Ĵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������װ�ý�����Ӧʵ�飬�ܴﵽʵ��Ŀ�ĵ��ǣ� ��
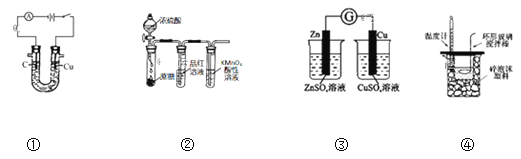
A.ͼ����ʾװ�ÿɵ��ʳ��ˮ������������
B.ͼ����ʾװ�ÿ�˵��ŨH2SO4������ˮ�ԡ�ǿ�����ԣ�SO2����Ư���ԡ���ԭ��
C.ͼ��װ�ÿ���������֤��ѧ��ת��Ϊ����
D.ͼ�ܲⶨ�к���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.ͬ�¡�ͬѹ�£���ͬ���������嶼ռ����ͬ�����
B.ͬ�¡�ͬѹ�£���ͬ��������嶼������ͬ��Ŀ�ķ���
C.����Ħ�����ԼΪ22.4 L/mol��һ�����ڱ�״����
D.18 g H2O�ڱ�״���µ����ԼΪ22.4 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1molL-1NaOH��Һ�ֱ�ζ�20.00mL0.1molL-1������ͱ�������Һ���ζ���������ͼ��ʾ������˵����ȷ����

A.ͼ����ͼ���ֱ���NaOH��Һ�ζ������ᡢ���������
B.V(NaOH)=10.00mLʱ���ζ�������Ļ����Һ��c(C6H5COO-)> c(Na+)> c(H+)>c(OH-)
C.�ζ���������Һʱ���ѡ�ü�����ָʾ��
D.�ﵽB��D״̬ʱ��NaOH��Һ�ֱ������ᡢ������ǡ�÷����кͷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ�����п����Ҫ�ɷ�ZnS����Fe��Cu��Cd��Ԫ�ص����ʣ�Ϊԭ�ϣ�ͨ����ʪ����п�����ַ��������Ƚ���п���յõ���ZnOΪ��Ҫ�ɷֵı�ɰ���ٷֱ��Ƶ�п�������������£�
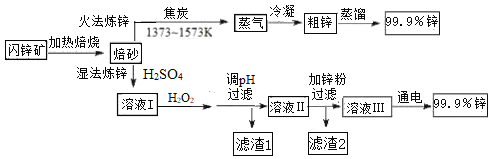
��֪��
Fe3+ | Zn2+ | Cu2+ | Fe2+ | Cd2+ | |
��ʼ������pH | 1.1 | 5.9 | 4.7 | 7.6 | 6.9 |
������ȫ��pH | 3.2 | 8.1 | 6.7 | 9.6 | 9.7 |
(1)����п�漰����Ҫ��Ӧ��
2C(s) + O2(g) = 2CO(g) H=��220 kJ�� mol-1
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) H=��930 kJ�� mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) H= +198 kJ�� mol-1
��ZnS(s) + 2O2(g) + C(s) = Zn(g) +CO2(g) + SO2(g) ��H=_______________��
(2)ʪ����п�����м���˫��ˮ��Ŀ����____________������pH�ķ�Χ��________������1�ijɷ���___________��д��ѧʽ��������2�ijɷ���___________��д��ѧʽ����
(3)��п��Һ����ɻ�����Ⱦ����Ҫԭ��֮һ��
����֪������п�����������������ơ�������Һ�м����Թ�����KOH��Һ�������������ʲ���Ӧ����������Ӧ�����ӷ���ʽ��_______________��
��һ������п���¼����������ⷨ��ԭ���ǣ���ZnO����KOH��Һ�õ����ǻ���п���[K2Zn(OH)4]��Һ���ٵ�����Һ����ý���п����ʯī�缫���ʱ�����ķ�Ӧʽ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��AG��ʾ��Һ��ȣ�![]() �������£���0.1mol/L��NaOH��Һ�ζ�25 ml 0.1mol/L��CH3COOH�ζ������ͼ��ʾ�����з�����ȷ���ǣ���
�������£���0.1mol/L��NaOH��Һ�ζ�25 ml 0.1mol/L��CH3COOH�ζ������ͼ��ʾ�����з�����ȷ���ǣ���
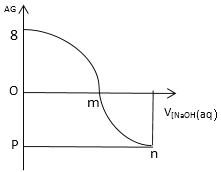
A.0.1mol/L�� CH3COOH��Һ��pH��3
B.m�����NaOH�����Ϊ25mL
C.��pH��7������Һ��ˮ�����c(OH-)=1.0��10-3.5 mol/L
D.����NaOH��Һ���룬��Һ��ˮ�ĵ���̶�������m�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com