
【题目】下列实验操作正确的是( )
A.滴定前用待测液润洗锥形瓶
B.容量瓶和滴定管使用前均需要检漏
C.蒸馏完毕时,先关闭冷凝水,再停止加热
D.分液时,上层溶液先从上口倒出,下层溶液再从下口放出
科目:高中化学 来源: 题型:
【题目】有一反应:2E(g)+F(g)![]() 2G(g),图中曲线是该反应在不同温度下的平衡曲线,y轴表示F的转化率,图中有a、b、c三点,则下列描述中正确的是
2G(g),图中曲线是该反应在不同温度下的平衡曲线,y轴表示F的转化率,图中有a、b、c三点,则下列描述中正确的是

A. 该反应是放热反应
B. b点时混合气体的平均摩尔质量不再变化
C. T1温度下a点表示若想达到平衡,可以采取增大压强的方法
D. c 点可表V正逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol·L-1的下列物质的水溶液,从常温加热到90 ℃,溶液的pH几乎不变的是(不考虑水的蒸发)( )
A. 氯化钠 B. 氢氧化钾 C. 硫酸 D. 硫酸铵
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象或事实可用同一原理解释的是( )
A. 浓硫酸和浓盐酸长期暴露在空气中浓度降低
B. 氯水和活性炭使红墨水褪色
C. 铁片和铝片置于冷的浓硫酸中均无明显现象
D. 二氧化硫和过氧化钠使品红褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有3份等质量的小苏打,第1份直接与盐酸恰好完全反应:第2份首先加热, 使其部分分解后,再与足量盐酸恰好完全反应:第3份首先加热,使其完全分解后,再与足量盐酸恰好完全反应。假若盐酸的物质的量浓度相同,消耗盐酸的体积分别为V1、V2和V3,则V1、V2和V3的大小关系正确的是
A. V1>V2>V3 B. V1>V3>V2 C. V2>V3 >V1 D. V1=V2=V3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】150℃时,向下图所示的恒压容器中加入4LN2和 H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),正反应放热。反应后恢复到原温度。平衡后容器体轵变为3.4L,容器内气体对相同条件的氢气的相对密度为5。

(1)反应前混合气体中V(N2):V(H2)=______;反应达平衡后V(NH3)=__L;该反应中N2转化率为___。
(2)向平衡后的容器中充入0.2mol的NH3,一段时间后反应再次达到平衡,恢复到150℃时测得此过程中从外界吸收了6.44 kJ的热量。请回答:充入NH3时,混合气体的密度将__________(填“增大”、“减小”或“不变”),在达到平衡的过程中,混合气体的密度将____(填“增大”、“减小”或“不变”)。反应重新达平衡昀混合气体对氢气的相对密度将______5(填“>”、“<”或 “ = ”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于反应:2NO(g)+O2(g)![]() 2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
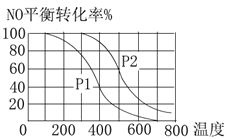
①比较p1、p2的大小关系:________。
②随温度升高,该反应平衡常数变化的趋势是________(填“增大”或“减小”)。
(2)在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),已知随温度升高,此混合气体的颜色变深。
2NO2(g),已知随温度升高,此混合气体的颜色变深。
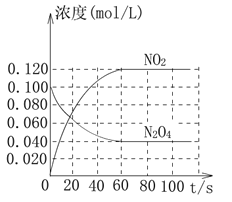
回答下列问题:
①反应的ΔH_________________________(填“大于”或“小于”)0;100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为____________mol·L-1·s-1;反应的平衡常数K1为____________________。
②100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。列式计算温度T时反应的平衡常数K2=_________________。
③温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________________(填“正反应”或“逆反应”)方向移动,判断理由是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com