
【题目】下列关于生物大分子的叙述中,错误的是
A. 蛋白质是以氨基酸为基本单位构成的生物大分子
B. 核酸是储存遗传信息、控制蛋白质合成的生物大分子
C. 淀粉、肝糖原、纤维素和核糖都是生物大分子
D. 多糖、蛋白质、核酸等是以碳链为骨架的生物大分子
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度为________。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

①毒重石用盐酸浸取前需充分研磨,目的是________。
②加入NH3·H2O调节pH=8可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL 0.01mol·L-1 Na2SO4溶液,下列叙述正确的是___(填字母)。

A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是
A. 酸性由大到小:HPO3>H3PO4>H3PO3 B. 硬度由大到小:金刚石>碳化硅>晶体硅
C. 熔点由高到低:Na>Mg>Al D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途不具有对应关系的是
A.FeCl3溶液呈酸性,可用于腐蚀Cu
B.小苏打受热分解生成气体,可用作发酵粉
C.氢氧化铝具有两性,可用于中和过多胃酸
D.Al2O3熔点高,可用作耐高温材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物是日常生活生产中应用广泛的材料。请回答下列问题:
(1)基态铁原子的价电子轨道表达式为_____________________ 。
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+____Fe3+(填“大于”“”或“小于”),原因是______________________ 。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH4+的结构式为_________________(标出配位键),空间构型为_______________,其中氮原子的杂化方式为_______________;与ClO4-互为等电子体的分子或离子有______(任写一种)。
(4)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该氧化物中Fe2+、Fe3+、O3-的个数比为___________(填最简整数比)。
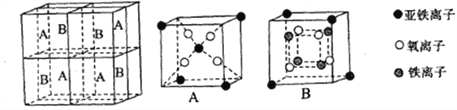
(5)铁有δ、γ、α三种同素异形体,如下图所示。

γ-Fe晶体的一个晶胞中所含有的铁原子数为________,δ-Fe、α-Fe两种晶胞中铁原子的配位数之比为_________。
已知δ-Fe晶体的密度为dg/cm3,NA表示阿伏伽德罗常数的数值,则Fe原子半径为_______Pm(列表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A. 60g丙醇中存在的共价键总数为10NA
B. 1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
C. 钠在空气中燃烧可生成多种氧化物。23g钠充分燃烧时转移电子数为1NA
D. 235g核互U![]() 发生裂变反应:
发生裂变反应:![]() +
+![]() n
n![]()
![]() +
+![]() +10
+10![]() n,净产生的中子(
n,净产生的中子(![]() n)数为10NA
n)数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:

据此回答下列问题:
(1)I、II、IV四步中对于溶液和沉淀的分离采取的方法是_________;获得沉淀后,要对沉淀进行洗涤,请简述洗涤沉淀的操作是______________________________________。
(2)根据上述框图反应关系,写出下列B、E所含物质的化学式并回答相关问题:
固体B_______;溶液液E_______;沉淀D的重要用途是__________________;KAl(SO4)2的重要用途是_____________________________。
(3)写出写出①、②、③三个反应的离子方程式:①______;②______;③______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素在地壳中含量丰富。下列有关说法不正确的是
A. 不锈钢属于铁合金B. 用KSCN溶液可检验溶液中的Fe3+
C. 铁制品腐蚀过程中铁被还原D. 浸在有机溶剂溶液中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com