
分析 (1)NaHSO3为离子化合物,熔融时电离出Na+和HSO3-离子;检验二氧化硫,可根据二氧化硫的漂白性;
(2)Na2SO3溶液显碱性,SO32-存在两步水解,以第一步水解为主,水解程度较小,据此判断离子浓度关系;
(3)在氧气作用下,二氧化硫、氢氧化钙反应生成硫酸钙;
(4)Na2S2O3为强碱若酸盐,水解呈碱性;
(5)Na2S2O3溶液加入氯水、氯化钡生成白色沉淀,应生成硫酸钡;
(6)由题意可知一个反应前后体积不变的可逆反应,由于容器恒容,因此压强不影响反应速率,所以在本题中只考虑温度和浓度的影响.结合图象可知反应速率先增大再减小,因为只要开始反应,反应物浓度就要降低,反应速率应该降低,但此时正反应却是升高的,这说明此时温度的影响是主要的,由于容器是绝热的,因此只能是放热反应,从而导致容器内温度升高反应速率加快.
解答 解:(1)NaHSO3为离子化合物,熔融时电离出Na+和HSO3-离子吗,电离方程式为NaHSO3=Na++HSO3-,二氧化硫具有漂白性,可使品红褪色,但生成物不稳定,加热可恢复到原来的颜色,则检验二氧化硫,
故答案为:NaHSO3=Na++HSO3-;能使品红褪色,褪色后的品红溶液受热后又可恢复到原来的颜色;
(2)Na2SO3溶液显碱性,SO32-存在两步水解:SO32-+H2O?HSO3-+OH-,HSO3-+H2O?H2SO3+OH-,以第一步水解为主,水解程度较小,则0.1mol/L Na2SO3溶液中的离子浓度顺序为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),故答案为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
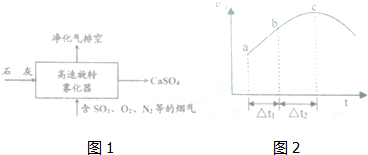
(3)高速旋转雾化器中涉及反应为二氧化硫、氧气和氢氧化钙反应生成硫酸钙,反应的方程式为2SO2+2Ca(OH)2+O2=2CaSO4+2H2O,
故答案为:2SO2+2Ca(OH)2+O2=2CaSO4+2H2O;
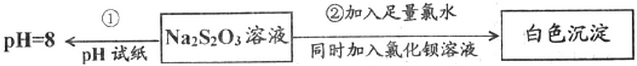
(4)常温下实验①测定溶液pH=8,说明Na2S2O3溶液呈碱性,H2S2O3是一种弱酸,Na2S2O3为强碱若酸盐,
故答案为:Na2S2O3溶液呈弱碱性,Na2S2O3为强碱若酸盐,H2S2O3是一种弱酸;
(5)验②发生反应是利用氯气氧化硫代硫酸钠为硫酸钠,说明Na2S2O3具有还原性,硫酸钠结合钡离子生成硫酸钡沉淀,反应的离子方程式:S2O32-+5H2O+4Cl2+2Ba2+=2BaSO4↓+8Cl-+10H+;
故答案为:还原;S2O32-+5H2O+4Cl2+2Ba2+=2BaSO4↓+8Cl-+10H+;
(6)A.化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,c点对应的正反应速率显然还在改变,故一定未达平衡,故A错误;
B.a到b时正反应速率增加,反应物浓度随时间不断减小,故B错误;
C.从a到c正反应速率增大,之后正反应速率减小,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,说明该反应为放热反应,即反应物的总能量高于生成物的总能量,故C正确;
D.随着反应的进行,正反应速率越快,消耗的二氧化硫就越多,SO2的转化率将逐渐增大,故D正确;
故选:CD.
点评 本题综合考查性质实验的设计,涉及含硫物质的性质的考查,为高频考点,涉及氧化还原反应、电离及盐类水解应用、离子浓度大小比较方法等,题目综合性较强,难度中等,侧重于考查学生对基础知识的综合应用能力.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题
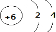 E的电子式为
E的电子式为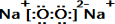 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知PM2.5是指大气中直径≤2.5×10-6m的颗粒物,则PM为2.5的大气一定能产生丁达尔现象 | |
| B. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| C. | ${\;}_{1}^{2}$H、${\;}_{1}^{3}$H是制造氢弹的原料,它们是同一种核素 | |
| D. | 太阳能电池可采用硅材料制作,其应用有利于环保、节能 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 10L | B. | 15L | C. | 25L | D. | 27L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
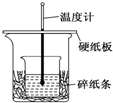 某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )
某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )| A. | 如图条件下实验过程中没有热量损失 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是固定小烧杯 | |
| D. | 若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,理论上所求反应热偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
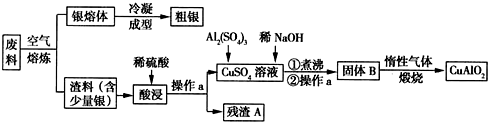
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com