
| 阴离子 | SO42-、NO3-、CO32-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
| A. | 若向原溶液中先加入少量盐酸,再滴入KSCN溶液,实验现象为有血红色沉淀生成 | |
| B. | 原溶液中含有的阳离子为Fe2+、Al3+ | |
| C. | 用排水法可收集所产生的气体体积为$\frac{22.4}{3}$L | |
| D. | a=160 |
分析 ①若向原溶液中加入KSCN溶液,无明显变化,则一定不含Fe3+;
②若向溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变,说明原溶液中含有Cl-,该气体只能是NO,说明含有具有氧化性的NO3-和还原性的Fe2+;原溶液中一定不存在HCO3-、CO32-;
③若向溶液中加入BaCl2溶液,有白色沉淀生成,说明原溶液中含有SO42-,各离子的物质的量均为0.1mol,根据电荷守恒可知还应含有Cu2+;
④若向原溶液中加入足量NaOH溶液至阳离子恰好沉淀完全,充分反应后静置一段时间,过滤、洗涤、烧灼、最终所得固体的质量为ag,得到的固体是氧化铁和氧化铜,根据铁原子、铜原子守恒计算固体质量.
解答 解:A.由上述分析可知,含有具有氧化性的NO3-和还原性的Fe2+,向原溶液中先加入少量盐酸,再滴入KSCN溶液,实验现象为有血红色溶液生成,故A错误;
B.由上述分析可知,含SO42-、NO3-、Cl-、Fe2+、Cu2+,且离子的物质的量均为1mol,遵循电荷守恒,故B错误;
C.收集气体为NO,若为标准状况下,由电子守恒可知,气体为$\frac{1mol×(3-2)}{(5-2)}$×22.4L/mol=$\frac{22.4}{3}$L,故C错误;
D.ag为氧化铁和氧化铜,由原子守恒可知0.5mol×160g/mol+1mol×80g/mol=160g,故D正确;
故选D.
点评 本题考查常见离子的推断,为高频考点,把握离子反应及现象、离子共存及氧化还原反应为解答的关键,侧重分析与实验能力的考查,注意电子守恒及氧化还原反应的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应及对离子方程式 | 评价 |
| A | 金属钠加入滴有酚酞的水中:Na+H2O═Na++OH-+H2↑ | 正确 |
| B | 等体积等物质的量浓度的AlCl3、Ba(OH)2、HCl溶液混合:Al3+3H+6OH-═Al(OH)3↓+3H2O | 正确 |
| C | 向硅酸钠溶液中通入过量CO2:SiO32-+2H2O+2CO2═H2SiO3↓+2HC3-O | 错误,CO2过量溶液应该变澄清 |
| D | 向氯化钠铝溶液中加入足量氨水溶液:Al3++4NH3•H2O═AlO2+2H2O+4NH4+ | 正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
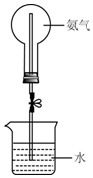 某学习小组研究氨气的喷泉实验.
某学习小组研究氨气的喷泉实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
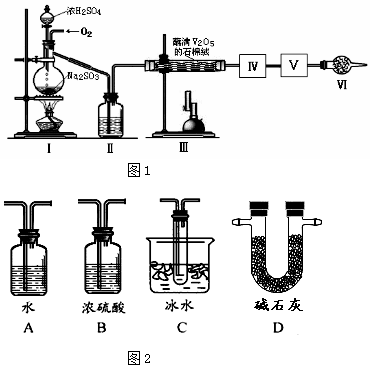
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com