
分析 反应中锰元素化合价变化为:+7→+2;部分氯元素化合价变化为:-1→0;依据氧化还原反应得失电子守恒结合原子个数守恒书写氧化还原反应方程式,依据反应中元素化合价变化判断氧化剂、还原产物,被氧化元素,依据方程式计算电子转移数目,氧化产物与还原产物的物质的量之比.
解答 解:反应中锰元素化合价变化为:+7→+2;部分氯元素化合价变化为:-1→0,要使得失电子守恒,则高锰酸钾系数为2,氯气系数为5,依据原子个数守恒,氯化锰系数为2,氯化钾系数为2,氯化氢系数为16,水系数为8,方程式:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,反应中锰元素化合价降低,所以高锰酸钾做氧化剂,对应产物氯化锰为还原产物;氯元素化合价升高,被氧化,氯气为氧化产物;生成1mol氯气转移2mol电子;氧化产物与还原产物的物质的量之比为:5:2;
故答案为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;KMnO4;MnCl2;Cl;2mol;5:2.
点评 本题考查了氧化还原反应基本概念及电子转移数目计算,明确氧化还原反应得失电子守恒是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:2 | |
| B. | 若有1mol电子转移,则氧化产物的物质的量是0.5mol | |
| C. | 据此反应原理,可以在酸性条件下用淀粉碘化钾试纸检验NO${\;}_{2}^{-}$的存在 | |
| D. | 若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g 质量分数为46%的乙醇水溶液中所含氢原子数为0.6NA | |
| B. | 将标准状况下22.4LNO与11.2LO2混合后的体积约为22.4L | |
| C. | 在反应KClO4+8HCl═KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为7NA | |
| D. | 6g石英晶体中含有的Si-O键数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在室温和常压下,71 g Cl2含有2NA个Cl原子 | |
| B. | 在同温、同压下,相同体积的任何气体,所含分子数和原子数都相同 | |
| C. | 物质的量浓度为1 mol/L的K2SO4溶液中,含2NA个K+ | |
| D. | 100g 98%的硫酸溶液中所含氢原子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.2g | B. | 10.6g | C. | 6.2g | D. | 4.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 mol•L-1的H2A溶液 | |
| B. | 0.01 mol•L-1NaHA溶液 | |
| C. | 0.02 mol•L-1HCl溶液与0.04 mol•L-1NaHA溶液等体积混合 | |
| D. | 0.02mol•L-1 NaOH溶液0.02 mol•L-1 NaHA溶液等体积混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
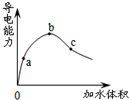
| A. | pH值:b>a>c | |
| B. | 与锌反应起始速率:a=b=c | |
| C. | 水电离的c(H+) c>a>b | |
| D. | 加入足量的NaHCO3固体,产生气体体积:a>b>c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com