
| A. | 在室温和常压下,71 g Cl2含有2NA个Cl原子 | |
| B. | 在同温、同压下,相同体积的任何气体,所含分子数和原子数都相同 | |
| C. | 物质的量浓度为1 mol/L的K2SO4溶液中,含2NA个K+ | |
| D. | 100g 98%的硫酸溶液中所含氢原子的数目为2NA |
分析 A、求出氯气的物质的量,然后根据氯气为双原子分子来分析;
B、气体分为单原子分子、双原子分子和多原子分子;
C、溶液体积不明确;
D、硫酸溶液中,除了硫酸本身,水也含氢原子.
解答 解:A、71g氯气的物质的量为1mol,而氯气为双原子分子,故1mol氯气中含2NA个氯原子,故A正确;
B、同温同压下,体积相同的任何气体的物质的量相同,但气体分为单原子分子、双原子分子和多原子分子,故含有的原子个数不一定相同,故B错误;
C、溶液体积不明确,故溶液中含有的钾离子的个数无法计算,故C错误;
D、硫酸溶液中,除了硫酸本身,水也含氢原子,故溶液中氢原子的个数大于2NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 小苏打和盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 氢氧化铝溶于强碱:Al(OH)3+OH-═AlO2-+2H2O | |
| C. | 氢氧化钡溶液与硫酸溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与醋酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| B. | 双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
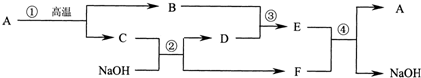
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
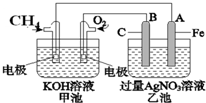 如图是一个电化学过程的示意图.已知甲池的总反应式为
如图是一个电化学过程的示意图.已知甲池的总反应式为查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入适量的氯化铵晶体后,两溶液的pH均减小 | |
| B. | 温度升高到50℃,两溶液的pH均不会发生变化 | |
| C. | 用同浓度的盐酸中和,消耗的盐酸体积相同 | |
| D. | 分别加水稀释到10倍体积,稀释后两溶液的pH仍相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先后通入溴水和澄清石灰水 | |
| B. | 点燃后罩上涂有澄清石灰水的烧杯,通入溴水 | |
| C. | 点燃后罩上干燥的冷烧杯 | |
| D. | 点燃后罩上涂有澄清石灰水的烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 | |
| B. | 钢铁发生吸氧腐蚀的正极反应式为O2+2H2O+4e-═4OH- | |
| C. | 在海轮外壳上镶入锌块,锌作负极,可减缓船体的腐蚀速率 | |
| D. | 在潮湿的空气中,镀锌铁板比镀锡铁板更耐腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com