
| A. | 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 | |
| B. | 钢铁发生吸氧腐蚀的正极反应式为O2+2H2O+4e-═4OH- | |
| C. | 在海轮外壳上镶入锌块,锌作负极,可减缓船体的腐蚀速率 | |
| D. | 在潮湿的空气中,镀锌铁板比镀锡铁板更耐腐蚀 |
分析 A、海水中含有电解质氯化钠;
B、吸氧腐蚀中,正极氧气得到电子生成氢氧根离子;
C、锌比铁活泼,可作原电池的负极;
D、铁、锡和合适的电解质溶液构成的原电池中,铁作负极,易被腐蚀,锌、铁和合适的电解质溶液构成的原电池中,锌作负极,铁作正极被保护.
解答 解:A、海水中含有电解质氯化钠,氯化钠可与钢铁形成原电池,原电池能加快化学反应速率,故A错误;
B、钢铁发生吸氧腐蚀的正极氧气得到电子生成氢氧根离子,正确的反应式为:O2+2H2O+4e-═4OH-,故B正确;
C、在海轮外壳上镶入锌块,可形成原电池反应,锌比铁活泼,可作原电池的负极,被氧化,从而起到防止铁被氧化的目的,故C正确;
D、镀层破损后,镀锡铁板中铁加快腐蚀,镀锌铁板中铁被保护,所以镀锌铁板比镀锡铁板更耐腐蚀,故D正确;
故选A.
点评 本题考查了金属的腐蚀的防护,明确金属腐蚀原理及防护方法是解题关键,注意电化学腐蚀的原理,题目难度不大.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 在室温和常压下,71 g Cl2含有2NA个Cl原子 | |
| B. | 在同温、同压下,相同体积的任何气体,所含分子数和原子数都相同 | |
| C. | 物质的量浓度为1 mol/L的K2SO4溶液中,含2NA个K+ | |
| D. | 100g 98%的硫酸溶液中所含氢原子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
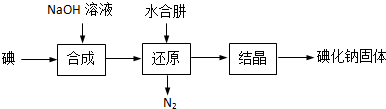
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 它的分子式是C8H8 | B. | 与苯乙烯 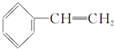 互为同分异构体 互为同分异构体 | ||
| C. | 它不能发生加成反应 | D. | 它的二氯取代物共有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体硝酸铵 | B. | 氯化钠 | C. | 生石灰 | D. | 固体氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
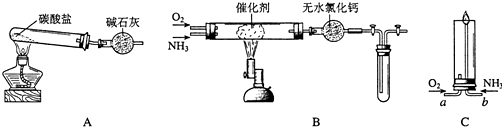
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量NaHCO3和Na2CO3的分别与足量盐酸完全反应,Na2CO3产生的CO2少 | |
| B. | 84g NaHCO3、106g Na2CO3分别与同浓度足量盐酸完全反应,Na2CO3消耗盐酸的是NaHCO3两倍 | |
| C. | 将澄清石灰水、CaCl2溶液分别倒入两种盐溶液中,都只有Na2CO3产生沉淀 | |
| D. | 通常情况下,Na2CO3的溶解度大于NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Na+、Cl-、NO${\;}_{3}^{-}$ | B. | H+、Na+、Cl-、CO32- | ||
| C. | Na+、Ag+、Cl-、OH- | D. | Na+、Ca2+、Cl-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com