
����Ŀ��ij��Һ���ܺ���H����K����Mg2����Al3����Fe3����Cl����SO![]() ��CO
��CO![]()
��1��ȡ����Һ20 mL������NaOH��Һ��ֻ������ɫ�������Ҳ����ij����������1.0 mol��L��1NaOH��Һ�����֮��Ĺ�ϵ��ͼ��ʾ��ˮ����һ�����е���������___________�������ʵ���֮����_________�������ų�______�Ĵ��ڡ�
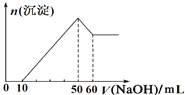
��2����ȡ����Һ20 mL��������BaCl2��Һ���õ�4.66 g����������ij������Ը�������ʵ���Ʋ�Cl���Ƿ���ڣ�___ (����������������)��
��3����ȷ����������______����ͨ��____________����ȷ�����Ƿ���ڡ�
���𰸡� H+�� Al3+ ��Mg2+ 2��2��1 Fe3+��CO32- �� K+ ��ɫ��Ӧ
�������������������1������10 mL 1.0 mol��L��1 NaOH��Һû�г���������˵��ԭ��Һ����H������H�����ʵ�����0.01mol������NaOH��Һ��ֻ������ɫ������˵��û��Fe3������������������������������������٣��Ҳ�����ȫ�ܽ���˵��ԭ��Һ����Mg2����Al3��������10 mL![]() 50mLNaOH��Һ�����ķ�Ӧ��
50mLNaOH��Һ�����ķ�Ӧ��![]() ��
�� ![]() ������50 mL
������50 mL![]() 60mLNaOH��Һ�����ķ�Ӧ��
60mLNaOH��Һ�����ķ�Ӧ��![]() ��Mg2����Al3����CO32-���ܹ���������һ������CO32-����2����ȡ����Һ20 mL��������BaCl2��Һ���õ�4.66 g����������ij������ó��������ᱵ�����ʵ�����0.02mol������ԭ��Һ����0.02mol SO
��Mg2����Al3����CO32-���ܹ���������һ������CO32-����2����ȡ����Һ20 mL��������BaCl2��Һ���õ�4.66 g����������ij������ó��������ᱵ�����ʵ�����0.02mol������ԭ��Һ����0.02mol SO![]() �����ݵ���غ��Ʋ�Cl���Ƿ��������3��K+ ����ͨ����ɫ��Ӧ������
�����ݵ���غ��Ʋ�Cl���Ƿ��������3��K+ ����ͨ����ɫ��Ӧ������
��������1������10 mL 1.0 mol��L��1 NaOH��Һû�г���������˵��ԭ��Һ����H������H�����ʵ�����0.01mol������NaOH��Һ��ֻ������ɫ������˵��û��Fe3������������������������������������٣��Ҳ�����ȫ�ܽ���˵��ԭ��Һ����Mg2����Al3��������10 mL![]() 50mLNaOH��Һ�����ķ�Ӧ��
50mLNaOH��Һ�����ķ�Ӧ��![]() ��
�� ![]() ������50 mL
������50 mL![]() 60mLNaOH��Һ�����ķ�Ӧ��
60mLNaOH��Һ�����ķ�Ӧ��![]() ���������Ϸ�����
���������Ϸ����� ![]() ������������0.01mol������Ԫ���غ��֪ԭ��Һ����0.01molAl3����
������������0.01mol������Ԫ���غ��֪ԭ��Һ����0.01molAl3���� ![]() ��
�� ![]() ��������������0.04mol�� 0.01molAl3��ͨ����Ӧ
��������������0.04mol�� 0.01molAl3��ͨ����Ӧ![]() ����0.03mol�������ƣ�����
����0.03mol�������ƣ�����![]() ������������0.01mol��ԭ��Һ����0.005mol Mg2����ˮ����һ�����е���������H+�� Al3+ ��Mg2+�������ʵ���֮����0.01:0.01:0.005=2��2��
������������0.01mol��ԭ��Һ����0.005mol Mg2����ˮ����һ�����е���������H+�� Al3+ ��Mg2+�������ʵ���֮����0.01:0.01:0.005=2��2��![]() ��H+�� Al3+ ��Mg2+�������������=0.01
��H+�� Al3+ ��Mg2+�������������=0.01![]() +0.01
+0.01![]() +0.005
+0.005![]() =0.05mol��SO
=0.05mol��SO![]() ���������������0.02mol
���������������0.02mol![]() =0.04mol�����ݵ���غ���һ������Cl������3���������Ϸ�������ȷ����������K+ ������ͨ����ɫ��Ӧ����K+�Ƿ������
=0.04mol�����ݵ���غ���һ������Cl������3���������Ϸ�������ȷ����������K+ ������ͨ����ɫ��Ӧ����K+�Ƿ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʳ�ַ�Ӧ����ˣ�����Һ���ȡ����ɡ��������������䣬���ղ��ܵõ����������
A. ��Ư����Һ��ͨ�������CO2
B. ���������Ĥ����Ƭ�м�������
C. ����1molCa(HCO3)2����Һ�м���1molNa2O2
D. ����1molKAl(SO4)2����Һ�м���2molBa(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����25��ʱ��Kw=1.0��10��14 �� 100����Kw=1.0��10��12 �� ����˵��������ǣ� ��
A.100����ˮ�ĵ���̶Ƚϴ�
B.ǰ�ߵ�C��H+���Ϻ���С
C.ˮ�ĵ��������һ�����ȹ���
D.�¶�Խ�ߣ�KwԽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֶ���������Ԫ�أ����������ڱ��е�λ����ͼ��ʾ����֪RԪ�ص���������ϼ���������ϼ۵Ĵ�����Ϊ0��
����������⣺
��1��ZԪ�������ڱ��е�λ���� �� ͬ����ԭ�Ӱ뾶����Ԫ��������Ԫ�ط��ţ���
��2��X�ļ��⻯����M�ĵ��ʣ���һ�������¿��Է����û���Ӧ����ѧ����ʽΪ �� ��ԭ�����к��еĻ�ѧ����������
��3���ҹ����䡰���ۡ�ϵ�зɴ��ij������������X��Y��Һ̬�⻯����ȼ�ϡ���֪X��Y�������⻯���������ȣ����ҷ�Ӧʱ����������������Ⱦ�����ʡ�
��д�������⻯�ﷴӦ�Ļ�ѧ����ʽ �� ��Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ��
��X��Һ̬�⻯��ĵ���ʽ��
��4������˵����֤��R��Y�ǽ�����ǿ������____________��
A.R��Y�ĵ�����һ��������������RY2
B.Y���ʳ����������壬R�����ǹ���
C.Y���⻯���ȶ��Դ���R���⻯��
D.��Ȼ���д���Y���ʲ�����R����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ����Na+��Al3+��Cl����SO42�� �������ӣ���֪ǰ�������ӵĸ�����Ϊ3��2��1������Һ��Al3+�� SO42�������Ӹ�����Ϊ�� ��
A.1��2
B.1��4
C.3��4
D.3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ʊ�Fe(OH)3�����˵����ȷ����
A. ��NaOH��Һ�еμ�FeCl3������Һ
B. ����ˮ�еμӱ���FeCl3��ҺȻ��������
C. �������е�����ˮ����μ�����������FeCl3��Һ�������������ʺ��ɫ
D. �͵�FeCl3��Һ�еμ���������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ�����SO2��SO3��Ƚϣ�����˵���������( )
A. ���Ӹ���֮��Ϊ1��1 B. ������ԭ������֮��Ϊ3��4
C. ������Ϊ1��1 D. ������ԭ�Ӹ�����Ϊ2��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�һ����Ϊͬϵ����ǣ� ��
A.����ͼ���
B.CH3COOH��C3H6O2
C.![]() ��
�� ![]()
D.HCHO��CH3COOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2013��3���ҹ���ѧ�ұ�������ͼ��ʾ��ˮ��Һ����ӵ����ϵ����������������ǣ� �� 
A.aΪ��ص�����
B.��س�練ӦΪLiMn2O4�TLi1��xMn2O4+xLi
C.�ŵ�ʱ��a��﮵Ļ��ϼ۷����仯
D.�ŵ�ʱ����Һ��Li+��b��aǨ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com