
| A. | 标准状况下22.4L/mol 就是气体摩尔体积 | |
| B. | 非标准状况下,1mol 任何气体的体积不可能为22.4L | |
| C. | 标准状况下22.4L 任何气体都含有约6.02×1023个分子 | |
| D. | 1mol H2 和O2 的混合气体在标准状况下的体积约为44.8L |
分析 A.标准状况下气体摩尔体积约为22.4L/mol;
B.一定条件下,1mol气体的体积可能为22.4L;
C.标准状况下22.4L 任何气体的物质的量为1mol;
D.1mol混合气体在标准状况下体积约为22.4L.
解答 解:A.标准状况下气体摩尔体积约为22.4L/mol,是一个约数,故A错误;
B.温度越高气体的体积越大,压强越大,体积越小,在一定条件下,1mol气体的体积可能为22.4L,故B错误;
C.标准状况下22.4L 任何气体的物质的量为1mol,其含有的分子数约为6.02×1023个,故C正确;
D.1mol混合气体在标准状况下体积约为22.4L,2mol混合气体的体积才是约为44.8L,故D错误.
故选C.
点评 本题考查了气体的摩尔体积,题目难度不大,注意把握气体摩尔体积的适用条件,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:选择题
| A. | 该化合物的相对分子质量是62 | |
| B. | 该化合物的化学式为C2H6O2 | |
| C. | 1mol该化合物能与2molO2发生催化氧化反应 | |
| D. | 1mol该有机物最多能与2molNa反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂(Li)与水反应比钠与水反应剧烈 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | HBrO4的酸性比HClO4弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D>E | B. | B>A>C>D>E | C. | C>D>E>A>B | D. | E>D>C>B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
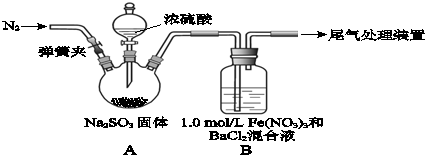
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液和CO2的反应 | B. | NaOH溶液和醋酸的反应 | ||
| C. | NaOH溶液和盐酸反应 | D. | 氨水和稀H2SO4的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com