
下列涉及的有机物及有机反应类型正确的是 ( )
A.苯与甲苯均可以使酸性高锰酸钾褪色
B.葡萄糖、蛋白质、纤维素都能发生水解反应
C.甲醛,氯乙烯,乙二醇均可做加聚反应的单体
D.乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应
科目:高中化学 来源: 题型:
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学知识回答下列问题:
Ⅰ.把氯气通入紫色石蕊溶液中,可以观察到的现象是:______________________。。
请你解释其中的原因___________________________________________。
Ⅱ.某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液。
(1)其反应原理为:(用化学方程式表示) _______________________________。
(2)实验室配制好4.0 mol·L-1的NaOH溶液500 mL,需要NaOH _______克。
(3)配制500 mL 4.0 mol·L-1 NaOH溶液的实验步骤:
a.计算需要氢氧化钠固体的质量。 b.称量氢氧化钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶。
d.用适量蒸馏水溶解称量好的氢氧化钠固体,冷却。
e.盖好瓶塞,反复上下颠倒,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1 cm~2 cm时,改用胶头滴管加蒸馏水至凹液面与刻度线相切。
上述步骤的正确操作顺序是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
(1)写出元素T在元素周期表中的位置 ▲ 。
(2)元素Y与元素Z相比,金属性较强的是 ▲ (用元素符号表示),下列表述中能证明这一事实的是 ▲ (填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
e.Y失去电子的数目比Z少
(3)T、X、Y、Z中有两种元素能形成一种淡黄色的固体,写出该化合物的电子式 ▲ ,该物质中含有的化学键是 ▲ 。
(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素形成的化合物W气态时密度等于氧气,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式 ▲ 。
(5) X与Z形成的化合物ZX结构类似金刚石,最高可稳定到2200℃,推测属于 ▲
晶体。打开盛有ZX的袋口可闻到氨气味,故应避水保存,写出变质反应的化学方程式
▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
铜既不溶于稀硫酸,也不溶于NaNO3溶液,但可溶于其混合液。现将1.92 g Cu放入足量的稀硫酸中,若要使铜完全溶解,理论上至少应加入NaNO3晶体的物质的量为( )
A.0.08 mol B.0.06 mol C.0.045 mol D.0.02 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
I:常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表
| 序号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
请回答:(1)根据①组实验情况,分析混合溶液的pH=9的原因是______________ ___。
(用反应的离子方程式表示),在该溶液中下列关系式不正确的是(填序号字母)________。
A.c(Na+)+c(H+)=c(OH-)+c(A-) B.c(Na+)=c(HA)+c(A-)
C.c(HA)+c(H+)=c(OH-) D.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c __0.2mol·L-1(选填“>”、“<”或“=”)。混合溶液中离子浓度
c(A-)________c(Na+)(选填“>”、“<”或“=”)
从③组实验结果分析,说明HA的电离程度________NaA的水解程度(选填“>”、“<”或“=”),离子浓度由大到小的顺序是______________________________________。
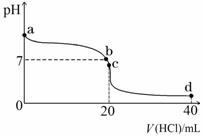 II:室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积
II:室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积
的变化曲线如下图所示。
(1)NH3·H2O的电离方程式是 。
(2)b点所示溶液中的溶质是 。
(3)c点所示溶液中,离子浓度从大到小的关系为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com