
【题目】对于锌一铜一稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是
①锌片溶解了32.5g②锌片增重 32.5g③铜片上析出lg H2 ④铜片上析出1mol H2
A.①和③ B.①和④ C.②和③ D.②和④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)配制稀硫酸时,先将浓硫酸加入烧杯中,后倒入蒸馏水(______)
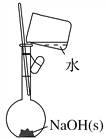
(2)称取2.0 g NaOH固体,可先在托盘上各放一张滤纸,然后在右盘上添加2 g砝码,左盘上添加NaOH固体(_______)
(3)按照下图操作,配制一定浓度的NaCl溶液(_____)

(4)按照下图操作,配制0.10 mol·L-1 NaOH溶液(______)
(5)配制溶液定容时,俯视容量瓶刻度会使溶液浓度偏高(_______)
(6)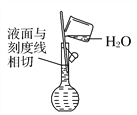 配制溶液(_______)
配制溶液(_______)
(7)因为Ca(OH)2能制成澄清石灰水,所以可配制2.0 mol·L-1的Ca(OH)2溶液(_____)
(8)配制0.100 0 mol·L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流(_______)
(9)用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小(________)
(10)用固体NaCl配制0.5 mol·L-1的溶液,所用的仪器有:烧杯、玻璃棒、胶头滴管、容量瓶(_______)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
a | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
b | 基态原子的p轨道电子数比s轨道电子数少1 |
c | 在周期表所列元素中电负性最大 |
d | 位于周期表中第4纵行 |
e | 基态原子M层全充满,N层只有一个电子 |
请回答:
(1)d属于_____区的元素,其基态原子的价电子排布图为_____。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为_____(用元素符号表示)。
(3)c的氢化物水溶液中存在的氢键有_____种,任意画出一种:_____。
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为_____ (用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为_____;A的中心原子的轨道杂化类型为_____;与A互为等电子体的一种分子为_____ (填化学式)。
(5)向e的硫酸盐中加入氨水首先形成蓝色沉淀,继续滴加氨水沉淀溶解,得到深蓝色的透明溶液,试用离子方程式解释产生这一现象的原因:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:
CO(NH2)2+2NaOH+NaClO==Na2CO3+N2H4·H2O+NaCl
据此,某学生设计了下列实验.
【制备NaClO溶液】实验装置如下图左图所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3

(1)配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_______________;Ⅱ中玻璃管a的作用为____________;为了提高NaClO的产率,需对I中产生的Cl2进行净化,所用试剂是________________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的___________________
【制取水合肼】实验装置如上图右图所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2 H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式____________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品,B装置的名称是______________
【测定肼的含量】
(4)称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol.L-1 的I2溶液滴定。
已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为____________;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X+Y═M+N为放热反应,对该反应的说法正确是
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因为该反应为放热反应,故不必加热就可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式:2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH===2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为( )
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L恒容密闭容器中,发生反应 2NO(g)+O2(g)![]() 2NO2(g)。
2NO2(g)。
⑴某温度时,按物质的量比2∶1充入NO和O2开始反应,n(NO)随时间变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.007 | 0.006 | 0.006 | 0.006 |
0~4s内以O2浓度变化表示的反应速率__________1~5s内以NO浓度变化表示的反应速率(选填“小于”、“大于”、“等于”)。
⑵该反应的平衡常数表达式为K=______。能说明该反应已达到平衡状态的是_____。
A.气体颜色保持不变 B.气体平均相对分子质量保持不变
C.υ逆(NO)=2υ正(O2) D.气体密度保持不变
⑶已知:K300℃>K400℃。下列措施能使该反应的反应速率增大且平衡向正反应方向移动的是________。
A.升高温度 B.充入Ar使压强增大 C.充入O2使压强增大 D.选择高效催化剂
⑷将amolNO和bmolO2发生反应,要使反应物和生成物物质的量之比为1∶2,则a/b的取值范围是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A.乙烯水化制乙醇;溴乙烷水解制乙醇
B.由乙醇制乙烯;溴乙烷与氢氧化钠醇溶液共热制乙烯
C.苯硝化制硝基苯;乙烯使酸性高锰酸钾溶液褪色
D.甲苯使酸性高锰酸钾溶液褪色;丙炔使溴的四氯化碳溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com