
| 编号 | 热化学方程式 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 |
分析 (1)由盖斯定律可知,通过①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),△H进行相应的改变;化学平衡常数K=K12.K2.K3;
(2)新工艺中反应③消耗反应②中的产物H2O,减小生成物的浓度,有利于平衡向正反应方向移动;
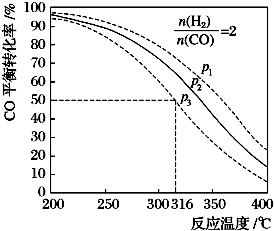
(3)升高温度CO转化率降低,说明平衡逆向移动;H2和CO的物质的量之比等于系数比,则两者的转化率相等;相同温度下,增大压强平衡正向移动,则CO转化率增大;
(4)该燃料电池中,负极上二甲醚失电子和氢氧根离子反应生成碳酸根离子和水,正极上氧气得电子和水反应生成氢氧根离子.
解答 解:(1)2H2(g)+CO(g)?CH3OH(g)△H=-90.0kJ.mol-1 ①
2CH3OH(g)?CH3OCH(g)+H2O (g)△H=-24.5kJ.mol-1②
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.1kJ.mol-1③
由盖斯定律可知,通过①×2+②+③可得所求反应方程式,则△H=-90.0kJ/mol×2-24.5kJ/mol-41.1kJ/mol=-245.6kJ/mol,所以热反应方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-245.6kJ/mol,化学平衡常数K=K12.K2.K3;
故答案为:-245.6kJ/mol;K12.K2.K3;
(2)反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率,
故答案为:反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动;
(3)升高温度CO转化率降低,说明平衡逆向移动,则正反应是放热反应,△H<0;H2和CO的物质的量之比等于系数比,则两者的转化率相等,则氢气转化率为50%;相同温度下,增大压强平衡正向移动,则CO转化率增大,根据CO转化率知,P1>P2>P3,
故答案为:<;50%;P1>P2>P3;增大压强平衡正向移动CO转化率增大;
(4)二甲醚、空气、KOH溶液为原料总电池反应方程式为:CH3OCH3+3O2+4OH-=2CO32-+5H2O,正极电极反应式为:3O2+6H2O+2e-=12e-,负极反应式为CH3OCH3-12e-+16OH -=2CO32-+11H2O,
故答案为:CH3OCH3-12e-+16OH -=2CO32-+11H2O.
点评 本题考查化学平衡计算、外界条件对化学平衡移动影响、原电池原理等知识点,侧重考查学生对化学平衡移动影响因素的理解和灵活运用,知道温度、压强如何影响平衡移动,难点是(4)题电极反应式的书写.


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:计算题
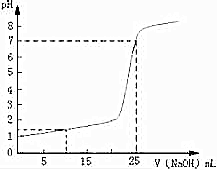 常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示:
常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | 800 | 1000 | 1100 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 48.1 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F-的原子结构示意图: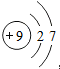 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 葡萄糖的分子式:C6H12O6 | D. | 二氧化碳的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机.
丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机. | 500 | 600 | 700 | 800 |
| 1.67 | X | 33 | ||
| 1.25 | 60 | 43 | Y | |
| 0.83 | Z | 32w |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 L Cl2与5 L HCl | |
| B. | 36 g H2O与44.8 L CO2 | |
| C. | 25℃,1.01×105 Pa时,等体积的空气与H2 | |
| D. | 0.2 mol O2与标准状况下2.24 L水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com