
分析 (1)由①A(s)+O2(g)═CO2(g)△H=-393.51kJ/mol;②B(s)+O2(g)═CO2(g)△H=-395.41kJ/mol,根据盖斯定律:①-②分析反应的热效应,能量越高越不稳定;
(2)反应方程式为:H2+Cl2=2HCl,根据吸收的能量之和与放出的能量之和的相对大小判断反应的吸放热,二者的差值即为焓变的数值;
(3)据热化学方程式和盖斯定律计算写出热化学方程式;据图象写出水与甲烷反应的热化学方程式和氧气与甲烷反应的热化学方程式,再据热化学方程式计算.
解答 解:(1)由①A(s)+O2(g)═CO2(g)△H=-393.51kJ/mol;②B(s)+O2(g)═CO2(g)△H=-395.41kJ/mol,根据盖斯定律:①-②得:A(s)=B(s)△H>0,所以B的能量高,能量越高越不稳定,A稳定,
故答案为:A;
(2)反应方程式为:H2+Cl2=2HCl,生成2molHCl,需吸收能量:436kJ+243kJ=679kJ,放出能量:2×431kJ=862kJ,放出的能量大于吸收的能量,则该反应放热,焓变为负号,且放出的热量为:864kJ-679kJ=185kJ,所以△H=-183KJ/mol,所以反应的热化学方程式是H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ/mol;
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ/mol;
(3)①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=-72kJ•mol-1
②CH4(g)+H2O(g)═CO(g)+3H2(g)△H2=+216 kJ•mol-1
依据盖斯定律$\frac{1}{2}$①-②得到氢气与氧气反应生成水蒸气的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-252kJ•mol-1,CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ•mol-1
,2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=-72kJ•mol-1,
若x=0.2,有0.8molH2O(g)和0.2molO2(g),0.2mol氧气反应放热0.2mol×36KJ/mol×2=14.4KJ;
反应①与②放出(或吸收)的总能量为0时,设水蒸气物质的量为amol,则氧气物质的量为(1-a)mol,有216KJ/mol×amol=72KJ/mol×(1-a)mol,解得:a=0.26mol,所以x=$\frac{1-0.26}{1}$=0.75;
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-252kJ•mol-1;14.4;0.75.
点评 本题考查了据能量变化图书写热化学方程式和据热化学方程式的计算,注意盖斯定律的计算应用,题目难度中等.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖与银氨溶液反应会产生银镜现象 | |
| B. | 生吃新鲜蔬菜要比熟吃时维生素C的损失小 | |
| C. | 油脂在人体内酶的催化作用下水解为氨基酸 | |
| D. | 不慎误食重金属盐离子,应立即喝大量牛奶来缓解毒性,以减少人体蛋白质中毒的程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
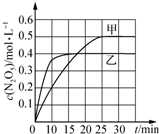 臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)十O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如表及图所示:
臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)十O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如表及图所示:| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 1 | 1 | 2 |
| 反应物 | |||
| 起始量 | 2mol NO2 | ||
| 1mol O3 | 2mol NO2 | ||
| 1mol O3 | 2mol N2O5 | ||
| 1mol O2 | |||
| 温度/K | T1 | T2 | T2 |
| A. | 0~10 min内甲容器中反应的平均速率:v(NO2)=0.02 mol•L-1•min-1 | |
| B. | T1<T2,△H>0 | |
| C. | 平衡时N2O5浓度:c乙(N2O5)>c丙(N2O5) | |
| D. | T1K时,若起始时向容器甲中充入2 mol NO2、1 mol O3、2 mol N2O5和2 mol O2,则脱硝反应达到平衡前,v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
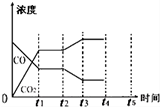
| 反应时间/min | n(CO)/mol | n (H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 编号 | 热化学方程式 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2013年12月17日,中国国土资源部召开新闻发布会,宣布在广东沿海珠江口盆地东部海域首次钻获高纯度可燃冰.可燃冰的主要成分是甲烷,甲烷既是清洁的燃料,也是重要的化工原料.
2013年12月17日,中国国土资源部召开新闻发布会,宣布在广东沿海珠江口盆地东部海域首次钻获高纯度可燃冰.可燃冰的主要成分是甲烷,甲烷既是清洁的燃料,也是重要的化工原料.| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.20 | 0.10 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 温度 | N2起始量/mol | N2的物质的量/mol | ||||||
| 5(s) | 10(s) | 15(s) | 20(s) | 25(s) | 30(s) | 35(s) | |||
| Ⅰ | T1 | 0.1 | 0.094 | 0.089 | 0.085 | 0.0825 | 0.081 | 0.080 | 0.080 |
| Ⅱ | T2 | 0.1 | 0.090 | 0.085 | 0.082 | 0.080 | 0.080 | 0.080 | 0.080 |
| Ⅲ | T3 | 0.2 | 0.179 | 0.165 | 0.153 | 0.146 | x | x | x |
| Ⅳ | T4 | 0.2 | 0.173 | 0.161 | 0.155 | 0.150 | 0.150 | 0.150 | 0.150 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 常温常压下,32g O2含有的氧原子数为2NA | |
| C. | 通常状况下,NA个CO2分子占有的体积为22.4L | |
| D. | 1L 0.1mol/L NaCl溶液中所含的Na+为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com