
| 反应时间/min | n(CO)/mol | n (H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
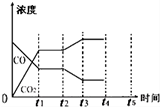
分析 (1)由化学计量数之比等于反应速率之比可知,v(H2)=v(CO),结合v=$\frac{△c}{△t}$计算;
(2)由以上数据可知,t2时n(H2O)=0.2mol,转化H2O的物质的量为0.4mol,转化的H2也为0.4mol,t2时n(H2)=0.4mol;
(3)根据反应方程式计算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始:1.2mol 0.6mol 0 0
转化:0.4mol 0.4mol 0.4mol 0.4mol
平衡:0.8mol 0.2mol 0.4mol 0.4mol
t1时达到达到平衡状态,平衡常数K=$\frac{\frac{0.4}{2}×\frac{0.4}{2}}{\frac{0.8}{2}×\frac{0.2}{2}}$=1,与800℃反应平衡常数为0.64比较判断温度对反应的影响;
(4)计算Qc,与K比较,判断反应进行的方向;
(5)据图可知,CO浓度继续减小和二氧化碳的浓度继续增大,在t2时刻平衡正向移动,结合平衡移动分析;
(6)结合平衡的特征“等、定”及衍生的物理量判定平衡状态.
解答 解:(1)化学反应中,反应速率之比等于化学计量数之比,v(H2)=v(CO)=$\frac{\frac{1.2mol-0.80mol}{2L}}{{t}_{1}min}$=$\frac{0.20}{{t}_{1}}$mol/(L•min),
故答案为:$\frac{0.20}{{t}_{1}}$;
(2)由以上数据可知,t2时n(H2O)=0.2mol,转化H2O的物质的量为0.4mol,转化的H2也为0.4mol,t2时n(H2)=0.4mol,与t1时相同,说明t1时达到达到平衡状态,根据化学方程式可知,则生成的n(CO2)=0.4mol,
故答案为:0.4;
(3)根据反应方程式计算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始:1.2mol 0.6mol 0 0
转化:0.4mol 0.4mol 0.4mol 0.4mol
平衡:0.8mol 0.2mol 0.4mol 0.4mol
t1时达到达到平衡状态,平衡常数K=$\frac{\frac{0.4}{2}×\frac{0.4}{2}}{\frac{0.8}{2}×\frac{0.2}{2}}$=1,而温度升至T2℃,上述反应的平衡常数为0.64,说明升高温度平衡向逆反应方向移动,则正反应放热,即△H<0,
故答案为:放热;
(4)Qc=$\frac{\frac{1.20}{2}×\frac{1.20}{2}}{\frac{1.20}{2}×\frac{2.00}{2}}$=0.6<1,平衡正向移动,v(正)>v(逆),故答案为:>;
(5)据图可知,CO浓度继续减小和二氧化碳的浓度继续增大,在t2时刻平衡正向移动,可能是增加水蒸汽的量或减少氢气的量,正反应放热,降温平衡正向移动,
故答案为:降低温度;增加水蒸汽的量( 或减少氢气的量);
(6)在一个绝热等容的容器中,判断此流程的第Ⅱ步反应CO(g)+H2O(g)?H2(g)+CO2(g),达到平衡的标志是正逆反应速率相同;各组分含量保持不变;
①虽然反应前后气体体积不变,但由于绝热等容容器中反应过程中有温度变化,所以压强也在变化,体系的压强不再发生变化能判断反应达到平衡,故①符合;
②反应中混合气体质量守恒,体积不变,密度不变,混合气体的密度不变不能说明反应达到平衡,故②不符合;
③反应前后气体质量守恒,反应前后气体体积不变,物质的量不变,混合气体的平均相对分子质量不变,不能说明反应达到平衡,故③不符合;
④各组分的物质的量浓度不再改变是平衡的标志,故④符合;
⑤体系的温度不再发生变化绝热容器温度不变,说明反应达到平衡,故⑤符合;
⑥反应速率之比等于化学方程式计量数之比,v(CO2)正=v(H2O)逆,说明水蒸气的正逆反应速率相同,故⑥符合;
故答案为:②③.
点评 本题考查化学平衡的计算,为高频考点,把握K的计算、反应进行的方向、平衡特征等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | KClO3发生还原反应 | |
| B. | H2C2O4在反应中被氧化 | |
| C. | H2C2O4的氧化性强于ClO2的氧化性 | |
| D. | 每生成1 mol ClO2,转移的电子数约为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子有7个σ键,1个π键 | |
| B. | 丙烯分子中的碳原子有sp3和sp2两种杂化类型 | |
| C. | 丙烯分子的所有原子共平面 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1 | |||||||||
| B. | H2(g)+Br2(g)═2HBr(g)△H=-72kJ•mol-1其它相关数据如下表:
| |||||||||
| C. | 在隔绝空气下,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则热化学方程式为Fe(s)+S(s)═FeS(s);△H=-95.6 kJ•mol-1 | |||||||||
| D. | 若2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为-241.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | 800 | 1000 | 1100 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 48.1 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机.
丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机. | 500 | 600 | 700 | 800 |
| 1.67 | X | 33 | ||
| 1.25 | 60 | 43 | Y | |
| 0.83 | Z | 32w |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知冰的融化热为6.0kJ.mol-1,冰中氢键键能为20kJ.mol-1.假设每摩尔冰中有2 mol 氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,Ka=$\frac{(ca)^{2}}{c(1-a)}$.若加入少量CH3COONa固体,则电离平衡CH3COOH?CH3COO-+H+向左移动,a减小,Ka变小 | |
| C. | 实验测得环己烷(1).环己烯(1)和苯(1)的标准燃烧热分别为-3916kJ.mol-1、-3747kJ.mol-1和-3265kJ.mol-1,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 已知:Fe2O3(s)+3C(石墨)═92Fe(s)+3CO(g)△H=489.0kJ.mol-1 CO(g)+$\frac{1}{2}$O2(g)═9CO2(g)△H=-283.0kJ.mol-1 C(石墨)+O2(g)═9CO2(g)△H=-393.5kJ.mol-1 则4Fe(s)+3O2(g)=94Fe2O3(s)△H=-1641.0kJ.mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com