
| A. | 已知冰的融化热为6.0kJ.mol-1,冰中氢键键能为20kJ.mol-1.假设每摩尔冰中有2 mol 氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,Ka=$\frac{(ca)^{2}}{c(1-a)}$.若加入少量CH3COONa固体,则电离平衡CH3COOH?CH3COO-+H+向左移动,a减小,Ka变小 | |
| C. | 实验测得环己烷(1).环己烯(1)和苯(1)的标准燃烧热分别为-3916kJ.mol-1、-3747kJ.mol-1和-3265kJ.mol-1,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 已知:Fe2O3(s)+3C(石墨)═92Fe(s)+3CO(g)△H=489.0kJ.mol-1 CO(g)+$\frac{1}{2}$O2(g)═9CO2(g)△H=-283.0kJ.mol-1 C(石墨)+O2(g)═9CO2(g)△H=-393.5kJ.mol-1 则4Fe(s)+3O2(g)=94Fe2O3(s)△H=-1641.0kJ.mol-1 |
分析 A.冰中含有氢键和H、O共价键,熔化时克服氢键,化学键不变;
B.加入少量CH3COONa固体,抑制醋酸的电离,并Kα表达式分析;
C.以燃烧热判断键能及键型很不可靠;
D.根据盖斯定律来分析热化学反应方程式及焓变.
解答 解:A.冰的熔化热为6.0kJ•mol-1,冰中氢键键能为20kJ•mol-1,则熔化破坏的氢键为:$\frac{6}{20×2}$×100%=15%,故A正确;
B.根据表达式Ka=$\frac{(ca)^{2}}{c(1-a)}$可知,增加CH3COONa固体,则电离平衡向左移动α减小,Kα的分子变小,分母变大故Kα减小,故B正确;
C.根据标准燃烧热的含义:1mol液体充分燃烧生成二氧化碳和液态水,但①消耗的氧气的量不同,产生的二氧化碳和水的量也不同,②苯中存在大π键,使键能升高,③若不考虑其他因素则:三种物质的内能应当是环己烷最低、苯次之、环己烯最高,而且燃烧热的结果是苯最小.根据以上结论,以燃烧热判断键能及键型很不可靠,故C错误;
D.根据盖斯定律可知,③×6-①×2-②×6得到目标式,则△H=-1641.0kJ•mol-1,故D正确;
故选C
点评 本题是关于计算的综合题,熟悉键能与熔化热、燃烧热判断键型的应用、电离度与电离平衡常数、反应热的盖斯定律计算等知识即可解答,注意做好各种相关计算教学是定量理解原理的意义所在,各知识点的计算都要达到理解、应用式计算而不是流于形式的简单算计,侧重考查各种反应量的计算能力.


科目:高中化学 来源: 题型:实验题
| 反应时间/min | n(CO)/mol | n (H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
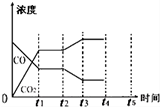
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
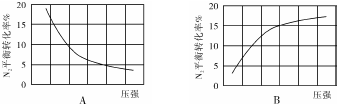
| 组别 | 温度 | N2起始量/mol | N2的物质的量/mol | ||||||
| 5(s) | 10(s) | 15(s) | 20(s) | 25(s) | 30(s) | 35(s) | |||
| Ⅰ | T1 | 0.1 | 0.094 | 0.089 | 0.085 | 0.0825 | 0.081 | 0.080 | 0.080 |
| Ⅱ | T2 | 0.1 | 0.090 | 0.085 | 0.082 | 0.080 | 0.080 | 0.080 | 0.080 |
| Ⅲ | T3 | 0.2 | 0.179 | 0.165 | 0.153 | 0.146 | x | x | x |
| Ⅳ | T4 | 0.2 | 0.173 | 0.161 | 0.155 | 0.150 | 0.150 | 0.150 | 0.150 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | |
| D | E | F |
 ,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32gO2和32gO3所含原子数目都为2NA | |
| B. | 标准状况下,11.2 L水中含有的原子数是1.5NA | |
| C. | 0.1 mol Fe参与化学反应转移的电子数一定为0.3NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 常温常压下,32g O2含有的氧原子数为2NA | |
| C. | 通常状况下,NA个CO2分子占有的体积为22.4L | |
| D. | 1L 0.1mol/L NaCl溶液中所含的Na+为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量g/mol | B. | 气体摩尔体积L/mol | ||
| C. | 溶解度g/100g | D. | 物质的量浓度mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com