
| 组别 | 温度 | N2起始量/mol | N2的物质的量/mol | ||||||
| 5(s) | 10(s) | 15(s) | 20(s) | 25(s) | 30(s) | 35(s) | |||
| Ⅰ | T1 | 0.1 | 0.094 | 0.089 | 0.085 | 0.0825 | 0.081 | 0.080 | 0.080 |
| Ⅱ | T2 | 0.1 | 0.090 | 0.085 | 0.082 | 0.080 | 0.080 | 0.080 | 0.080 |
| Ⅲ | T3 | 0.2 | 0.179 | 0.165 | 0.153 | 0.146 | x | x | x |
| Ⅳ | T4 | 0.2 | 0.173 | 0.161 | 0.155 | 0.150 | 0.150 | 0.150 | 0.150 |
分析 (1)知:①N2(g)+O2(g)=2NO(g)△H1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H2
③4NH3(g)+5O2(g)=4NO(g)+6H2O(1)△H3
根据盖斯定律,①+3×②-$\frac{1}{2}$×③得到N2(g)+3H2(g)?2NH3(g),据此计算反应的焓变;
(2)合成氨反应为放热反应,升高温度,转化率减小;增大压强平衡正向移动,转化率增大;
(3)①实验Ⅰ前10秒的平均速率v(N2)=$\frac{△c}{△t}$,物质表示的反应速率之比等于系数之比;合成氨反应的平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$,据此计算;
②催化剂只能加快反应速率不会引起K的变化;
③根据温度对平衡移动的影响知识来回答;
④对于放热反应,升高温度,K减小,对于吸热反应,温度升高,K增大.
解答 解:(1)知:①N2(g)+O2(g)=2NO(g)△H1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H2
③4NH3(g)+5O2(g)=4NO(g)+6H2O(1)△H3
根据盖斯定律,①+3×②-$\frac{1}{2}$×③得到N2(g)+3H2(g)?2NH3(g),△H4=△H1+3△H2-$\frac{1}{2}$△H3;故答案为:△H1+3△H2-$\frac{1}{2}$△H3;
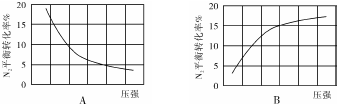
(2)合成氨反应为气体分子数减小的反应,增大压强,平衡正移,反应物的转化率增大,所以图B正确;
故答案为:B;合成氨反应为气体分子数减小的反应,增大压强,平衡正移,反应物的转化率增大;
(3)①实验Ⅰ前10秒的平均速率v(N2)=$\frac{\frac{0.1mol-0.089mol}{2L}}{10s}$=0.00055mol/(L•s),v(N2):v(NH3)=1:2,所以v(NH3)=0.0011mol/(L•s),N2+3H2?2NH3
初始浓度:0.05 0.15 0
变化浓度:0.01 0.03 0.02
平衡浓度:0.04 0.12 0.02
化学平衡常数K=$\frac{0.0{2}^{2}}{0.04×0.1{2}^{3}}$(mol•L-1)-2;故答案为:0.0011;$\frac{0.0{2}^{2}}{0.04×0.1{2}^{3}}$(mol•L-1)-2;
②实验Ⅱ和实验Ⅰ的温度一样,但是反应速率加快,所以反应是加入了催化剂,故答案为:加催化剂;
③温度不变,K不变,实验Ⅲ相当于在实验Ⅰ的基础上增加压强,平衡正向移动,氮气的转化率增加,故答案为:增大;不变;
④N2+3H2?2NH3
初始浓度:0.1 0.3 0
变化浓度:0.025 0.075 0.05
平衡浓度:0.075 0.225 0.05
该温度下K=$\frac{0.0{5}^{2}}{0.075×0.22{5}^{3}}$=2.93,要比实验Ⅰ温度下的平衡常数小,该温度下速率加快,应该是升温,但是平衡常数减小,所以反应放热,
故答案为:小于;T2时的平衡常数小于T1时的平衡常数且正反应放热.
点评 本题考查了平衡移动原理的应用、盖斯定律的应用、平衡常数的应用等,题目难度中等,侧重于基础知识的综合应用考查,注意把握影响化学平衡的因素.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子有7个σ键,1个π键 | |
| B. | 丙烯分子中的碳原子有sp3和sp2两种杂化类型 | |
| C. | 丙烯分子的所有原子共平面 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机.
丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机.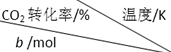 | 500 | 600 | 700 | 800 |
| 1.67 | X | 33 | ||
| 1.25 | 60 | 43 | Y | |
| 0.83 | Z | 32w |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加水时,平衡向逆反应方向移动 | |
| B. | 通入少量HCl,平衡向正反应方向移动 | |
| C. | 加入少量0.1mol/LNaOH,溶液中c(OH-)减小 | |
| D. | 加入少量NH4Cl固体,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
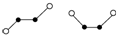 W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.基态W的原子核外有2个未成对电子,Q是电负性最大的元素,基态R的原子核外未成对电子数是W原子核外未成对电子数的2倍.请问答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.基态W的原子核外有2个未成对电子,Q是电负性最大的元素,基态R的原子核外未成对电子数是W原子核外未成对电子数的2倍.请问答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示): ,基态R原子的价电子排布式为3d64s2.
,基态R原子的价电子排布式为3d64s2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知冰的融化热为6.0kJ.mol-1,冰中氢键键能为20kJ.mol-1.假设每摩尔冰中有2 mol 氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,Ka=$\frac{(ca)^{2}}{c(1-a)}$.若加入少量CH3COONa固体,则电离平衡CH3COOH?CH3COO-+H+向左移动,a减小,Ka变小 | |
| C. | 实验测得环己烷(1).环己烯(1)和苯(1)的标准燃烧热分别为-3916kJ.mol-1、-3747kJ.mol-1和-3265kJ.mol-1,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 已知:Fe2O3(s)+3C(石墨)═92Fe(s)+3CO(g)△H=489.0kJ.mol-1 CO(g)+$\frac{1}{2}$O2(g)═9CO2(g)△H=-283.0kJ.mol-1 C(石墨)+O2(g)═9CO2(g)△H=-393.5kJ.mol-1 则4Fe(s)+3O2(g)=94Fe2O3(s)△H=-1641.0kJ.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应不需要加热就能发生 | |
| B. | 升高温度或加入催化剂,均可以改变化学反应的反应热 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 | |
| D. | 一定条件下某吸热反应能自发进行,说明该反应是熵增大的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com