
【题目】下列说法不正确的是
A.除去乙酸乙酯中残留的乙酸,可加过量饱和Na2CO3溶液振荡后,静置分液
B.某烷烃主链4个碳原子数的同分异构体有2种,则与其碳原子个数相同的且主链4个碳原子的单烯烃有4种
C.1mol有机物![]() 与NaOH溶液反应,最多消耗5mol NaOH
与NaOH溶液反应,最多消耗5mol NaOH
D.有机物![]() 分子中所有原子在同一平面内
分子中所有原子在同一平面内
【答案】D
【解析】
A.乙酸可以和饱和碳酸钠溶液反应生成溶于水的乙酸钠,乙酸乙酯在饱和碳酸钠溶液中溶解度较小,A正确;
B.某烷烃主链4个碳原子数的同分异构体有2种,支链是两个甲基,两个甲基连在同一个碳原子上形成一种,两个甲基连在2号和3号碳上形成一种,故该烷烃有6个碳原子,含有6个碳原子且主链有4个碳原子的单烯烃有:(CH3)2C=C(CH3)2、CH2=C(CH2CH3)2、CH2=C(CH3)CH(CH3)2、CH2=CHC(CH3)3,共4种,故B正确;
C.在氢氧化钠的水溶液中,羧基和氢氧化钠发生中和反应,酯基和肽键均发生水解,水解之后羧基和酚羟基均与氢氧化钠反应,酚羟基和氢氧化钠反应,故1mol![]() 最多消耗5mol氢氧化钠,C正确;
最多消耗5mol氢氧化钠,C正确;
D. ![]() 中含有1个饱和碳原子(—CH2OH中碳原子),与该碳原子直接相连的4个原子构成四面体,所有的原子不可能都在同一个平面内,D错误;
中含有1个饱和碳原子(—CH2OH中碳原子),与该碳原子直接相连的4个原子构成四面体,所有的原子不可能都在同一个平面内,D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】下列实验操作或装置正确的是
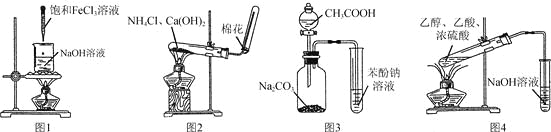
A.利用图1所示操作制备氢氧化铁胶体
B.利用图2所示装置制取NH3
C.利用图3所示装置证明H2CO3酸性强于苯酚
D.利用图4所示装置制备乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇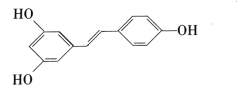 广泛存在于食物(如桑葚、花生,尤其是葡萄)中,它具有抗癌性。请回答下列问题。
广泛存在于食物(如桑葚、花生,尤其是葡萄)中,它具有抗癌性。请回答下列问题。
(1)白藜芦醇的分子式为_____,所含官能团的名称为_____;
(2)下列关于白藜芦醇的说法正确的是_____
A.可使酸性KMnO4溶液褪色
B.可与FeCl3溶液反应显紫色
C.可使溴的CCl4溶液褪色
D.可与NH4HCO3溶液反应产生气泡
E.属于醇类
F.不能发生酯化反应
(3)1mol该有机物最多能消耗____molNaOH,最多能消耗_____molBr2;
(4)1mol该有机物与H2加成时,最多消耗标准状况下的H2的体积为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如右图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3恰好反应时,消耗Na、NaOH、Na2CO3的物质的量之比是
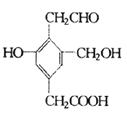
A.3:3:2B.6:4:3C.1:1:1D.3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A(g)+B(g)![]() 2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
(1)已知:A(g)+X(g)![]() 2B(g) ΔH=-133.2 kJ·mol-1;5A(g)+X(g)
2B(g) ΔH=-133.2 kJ·mol-1;5A(g)+X(g)![]() 4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
(2)不同温度下该反应的平衡常数如表所示。
由此可推知,表中T1________T2(填“>”“=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,C的浓度_________ω mol·L-1(填“>”“=”或“<”),a、b、c之间的关系为________。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是________(填序号)。
A.4 mol A和2 mol B
B.4 mol A、2 mol B和2 mol C
C.4 mol A和4 mol B
D.6 mol A和4 mol B
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出的热量为d kJ,则d________b(填“>”“=”或“<”)。
(5)在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,充分反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量________(填“增大”“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用如图所示装置探究二氧化硫气体的性质。

请回答:
(1)实验室用铜和浓硫酸共热制取二氧化硫,反应的化学方程式是__。
(2)当观察到②中溶液颜色变浅时,①中的现象是__。
(3)②中的溶液颜色变浅,说明二氧化硫具有的性质是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的有
①碱性氧化物:Na2O2、MgO、A12O3
②常温下Cu、Fe、Al均不能和浓硫酸发生化学反应
③Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
④分别以熔融的NaCl、MgCl2、Al2O3为原料通过电解法制取金属Na、Mg、Al
⑤碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的均一、透明的分散系分别为:溶液、胶体
A. ①④⑤ B. ③④⑤ C. ②③④ D. ②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com