
【题目】已知2A(g)+B(g)![]() 2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
(1)已知:A(g)+X(g)![]() 2B(g) ΔH=-133.2 kJ·mol-1;5A(g)+X(g)
2B(g) ΔH=-133.2 kJ·mol-1;5A(g)+X(g)![]() 4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
(2)不同温度下该反应的平衡常数如表所示。
由此可推知,表中T1________T2(填“>”“=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,C的浓度_________ω mol·L-1(填“>”“=”或“<”),a、b、c之间的关系为________。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是________(填序号)。
A.4 mol A和2 mol B
B.4 mol A、2 mol B和2 mol C
C.4 mol A和4 mol B
D.6 mol A和4 mol B
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出的热量为d kJ,则d________b(填“>”“=”或“<”)。
(5)在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,充分反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量________(填“增大”“减小”或“不变”)
【答案】258.6 < = a=b+c D > 不变
【解析】
⑴根据盖斯定律求算焓变数字。
⑵根据反应是放热反应,K减小,即逆向移动,说明是向吸热反应移动,即升温;只加2 molC与原平衡是等效平衡即浓度相等,吸收的热量与放出的热量之和等于焓变。
⑶反应是可逆反应,要达到2akJ,则反应物应该比4molA,2molB还要多才有可能达到2a kJ。
⑷现在是恒压容器,由于是体积减小的反应,因此相当于再原来的基础上加压,平衡正向移动,又不断消耗,反应放出的热量更多。
⑸恒温恒压,不等体积反应要达到等效,只需要对应成比例,将2molC全部转化为A、B,比例和前面的比例相同,因此两者为等效平衡,A的百分含量不发生改变。
⑴将第2个方程式减去第1个方程式再除以2,得到![]() ,则a=258.6,故答案为:258.6。
,则a=258.6,故答案为:258.6。
⑵该反应是放热反应,T1到T2,K减小,即逆向移动,逆向为吸热反应反应,说明是升温即T1 < T2,故答案为:<。
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,说明与原来的平衡是等效平衡,即C的浓度 = ω mol·L-1,绝对等效平衡建立,一个正向建立,一个逆向建立,则吸收的热量和放出的热量相加等于焓变数字,即a = b + c,故答案为:=;a = b + c。
(3)A选项,由于是可逆反应,因此4 mol A和2 mol B反应放出的热量小于2a kJ,故A错误;
B选项,由于是可逆反应,因此4 mol A、2 mol B反应放出的热量小于2a kJ,2 mol C反应还需要吸收热量,因此整个放出的热量小于2a kJ,故B错误;
C选项,由于是可逆反应,4 mol A和4 mol B反应,4 molA不可能全部反应完,因此放出的热量小于2a kJ,故C错误;
D选项,6 mol A和4 mol B参与反应,有可能完全反应完4 mol A和4 mol B,则放出的热量为2a kJ,故D正确。
综上所述,答案为D。
(4)容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,该反应是体积减小的反应,相当于再原来的基础上加压,平衡正向移动,即放出的热量更多,因此d>b,故答案为:>。
(5)在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,将2 molC全部转化为反应物,即相当于加了2molA和1molB,即4 mol A、3 mol B和2 mol C相当于加了6molA和4molB,与开始是等效的,A的百分含量不变,故答案为:不变。


科目:高中化学 来源: 题型:
【题目】有硫酸与硝酸的混合液,取出其中10mL,加入足量的BaCl2溶液,将生成的沉淀过滤洗涤,干燥称得质量为4.66g。另取这种溶液10mL与2mol·L-1的NaOH溶液25mL恰好中和。则:
(1)混合液中c(H2SO4)=__mol·L-1,c(HNO3)=__mol·L-1
(2)另取10mL的混合液(混合液中的硝酸视为稀硝酸)与0.96g铜粉共热时,产生气体的体积为__L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向一密闭容器中充入一定量的NH3,反应2NH3(g)![]() N2(g)+3H2(g)达到平衡时N2的体积分数与温度、压强的关系如图所示。下列说法正确的是
N2(g)+3H2(g)达到平衡时N2的体积分数与温度、压强的关系如图所示。下列说法正确的是

A. 压强:p1>p2
B. b、c两点对应的平衡常数:Kc>Kb
C. a点:2v(NH3)正=3v(H2)逆
D. a点:NH3的转化率为1/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.除去乙酸乙酯中残留的乙酸,可加过量饱和Na2CO3溶液振荡后,静置分液
B.某烷烃主链4个碳原子数的同分异构体有2种,则与其碳原子个数相同的且主链4个碳原子的单烯烃有4种
C.1mol有机物![]() 与NaOH溶液反应,最多消耗5mol NaOH
与NaOH溶液反应,最多消耗5mol NaOH
D.有机物![]() 分子中所有原子在同一平面内
分子中所有原子在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择装置,完成实验。
|
|
|
|
① | ② | ③ | ④ |
(1)喷泉实验,证明氨气极易溶于水,选用__(填序号,下同)。
(2)配制100mL0.1mol·L-1NaOH溶液,选用__。
(3)鉴别Na2CO3和NaHCO3固体,选用__。
(4)用于分离泥沙与食盐溶液,选用__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读有关硫代硫酸钠(Na2S2O3)的相关资料:
硫代硫酸钠是一种白色的晶体,可用作冲洗照相底片的定影剂、棉织物漂白后的脱氯剂及定量分析中的还原剂。它在碱性环境中能稳定存在,在酸性条件下发生反应生成SO2和S。制备Na2S2O3的方法很多,常用的方法有:Ⅰ.将纯碱溶解后,与二氧化硫作用生成亚硫酸钠,再加入硫磺沸腾反应,经过滤、浓缩、结晶,制得五水硫代硫酸钠(Na2S2O3·5H2O)。Ⅱ.硫化碱法:利用碳酸钠、硫化钠和废气中的二氧化硫反应,经吸硫、蒸发、结晶,制得硫代硫酸钠。Ⅲ.氧化、亚硫酸钠和重结晶法:由含硫化钠、亚硫酸钠和烧碱的液体经加硫氧化……。
回答下列问题:
(1)Na2S2O3和HCl反应的离子方程式___。
(2)方法Ⅰ中所包含的反应___(写方程式)。
(3)方法Ⅱ中做氧化剂的物质是___(化学式),做还原剂的是__(化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示M的结构简式,下列有关M的说法正确的是

A.M可以发生加成、加聚、水解、酯化等反应
B.1 mol M最多可以与3 mol NaOH反应
C.M苯环上的一氯取代物有两种不同结构
D.1 molM最多可以与5 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示,有关该物质的说法中正确的是![]()
![]()

A.该物质与苯酚属于同系物,遇![]() 溶液呈紫色
溶液呈紫色
B.滴入酸性![]() 溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.1mol该物质分别与浓溴水和![]() 反应时最多消耗
反应时最多消耗![]() 和
和![]() 分别为4mol和7mol
分别为4mol和7mol
D.该分子中的所有碳原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是
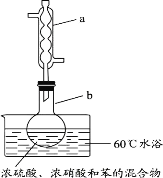
A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.仪器a的作用是冷凝回流,提高原料的利用率
C.浓硫酸、浓硝酸和苯混合时,应先向浓硫酸中缓缓加入浓硝酸,待冷却至室温后,再将苯逐滴滴入
D.反应完全后,可用蒸馏的方法分离苯和硝基苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com