
【题目】选择装置,完成实验。
|
|
|
|
① | ② | ③ | ④ |
(1)喷泉实验,证明氨气极易溶于水,选用__(填序号,下同)。
(2)配制100mL0.1mol·L-1NaOH溶液,选用__。
(3)鉴别Na2CO3和NaHCO3固体,选用__。
(4)用于分离泥沙与食盐溶液,选用__。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是
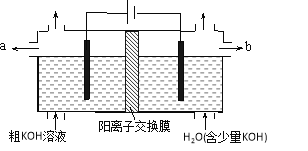
A. 通电后阴极区附近溶液pH会增大
B. 阳极反应式为4OH--4e-=2H2O+O2↑
C. 纯净的KOH溶液从b出口导出
D. K+通过交换膜从阴极区移向阳极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾具有强氧化性,广泛用于化工、医药、采矿、金属治炼及环境保护领域等。KMnO4的制备是以二氧化锰(MnO2)为原料,在强碱性介质中被氧化生成墨绿色的锰酸钾(K2MnO4);然后在一定pH下K2MnO4歧化生成紫色KMnO4。回答下列问题
(1)K2MnO4的制备
实验步骤 | 现象或解释 |
①称取2.5 gKClO3固体和5.2gKOH固体置于铁坩埚中,加热熔融 | 不用瓷坩埚的原因是____________。 |
②分多次加入3gMnO2固体 | 不一次加入的原因是__________________。 |
(2)KMnO4的制备
趁热向K2MnO4溶液中加入1 mol/L H3PO4溶液,直至K2MnO4全部歧化,判断全部歧化的方法是用玻璃棒蘸取溶液于滤纸上,现象为_________________________。然后趁热过滤,将滤液倒入蒸发皿中加热到液面出现晶膜,充分冷却后过滤,在80℃烘箱中干燥3h,不选用更高温度的原因是_____________________________。
(3)产品分析
i.不同pH下产品中KMnO4含量
加入H3PO4体积/mL | 溶液的pH | 产品质量 | KMnO4质量 | KMnO4质量分数 |
10.50 | 12.48 | 2.35 | 2.05 | 87.23 |
12.50 | 11.45 | 2.45 | 2.18 | 88.98 |
14.50 | 10.89 | 2.18 | 1.87 | 85.78 |
16.50 | 10.32 | 2.28 | 1.75 | 76.75 |
18.50 | 9.44 | 2.09 | 1.48 | 70.81 |
从表格中数据分析,在歧化时选择溶液的最佳pH是________________。
ii.利用H2C2O4标准溶液测定KMnO4的纯度。测定步骤如下:
①溶液配制:称取1.000g的KMnO4固体样品,放入_____________中溶解,然后冷至室温后全部转移到100mL容量瓶中,加蒸馏水至刻度线。
②滴定:移取25 mLKMnO4溶液于锥形瓶中,加少量硫酸酸化,用0.1400mol/L的H2C2O4标准溶液滴定,发生反应:2MnO4-+5H2C2O4+6H+=2Mn2++10C02+8H2O,当溶液紫色褪色且半分钟内不变色即为终点,平行滴定3次,H2C2O4溶液的平均用量为23.90mL,则样品纯度为_______________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、NO是大气污染物,NH4NO3、H2SO4等是水体污染物,有效去除这些污染物是一项重要课题。
(1) NO、SO2可以先氧化,后用碱吸收。其氧化过程的反应原理如下:
NO(g)+O3(g)![]() NO2(g)+O2(g);ΔH1=-200.9 kJ·mol-1
NO2(g)+O2(g);ΔH1=-200.9 kJ·mol-1
SO2(g)+O3(g)![]() SO3(g)+O2(g);ΔH2=-241.6 kJ·mol-1
SO3(g)+O2(g);ΔH2=-241.6 kJ·mol-1
2SO2(g)+O2(g)![]() 2SO3(g);ΔH3=-196.6 kJ·mol-1
2SO3(g);ΔH3=-196.6 kJ·mol-1
则反应2NO2(g)![]() 2NO(g)+O2(g)的ΔH=____kJ·mol-1。
2NO(g)+O2(g)的ΔH=____kJ·mol-1。
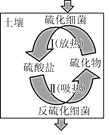
(2)土壤中的硫循环如图所示,土壤中的黄铁矿(FeS2)在过程Ⅰ中会转化成硫酸亚铁和硫酸,该过程发生的化学方程式为________________。
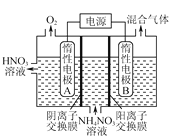
(3)电解法除去工业废水中的硝酸铵的装置示意图如图所示,阴极电极反应式为___。
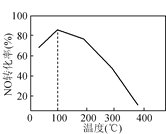
(4)向恒容密闭容器中充入1 mol NO和2 mol O3,发生如下反应:NO(g)+O3(g)![]() NO2(g)+O2(g);ΔH<0。不同温度下反应相同时间后,体系中NO转化率随温度变化曲线如图。温度低于100℃时,NO转化率随温度升高而增大的主要原因是____;当温度高时,O3分解生成活性极高的氧原子,NO转化率随温度升高而降低,可能的原因有:①______,②______。
NO2(g)+O2(g);ΔH<0。不同温度下反应相同时间后,体系中NO转化率随温度变化曲线如图。温度低于100℃时,NO转化率随温度升高而增大的主要原因是____;当温度高时,O3分解生成活性极高的氧原子,NO转化率随温度升高而降低,可能的原因有:①______,②______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A(g)+B(g)![]() 2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
(1)已知:A(g)+X(g)![]() 2B(g) ΔH=-133.2 kJ·mol-1;5A(g)+X(g)
2B(g) ΔH=-133.2 kJ·mol-1;5A(g)+X(g)![]() 4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
(2)不同温度下该反应的平衡常数如表所示。
由此可推知,表中T1________T2(填“>”“=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,C的浓度_________ω mol·L-1(填“>”“=”或“<”),a、b、c之间的关系为________。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是________(填序号)。
A.4 mol A和2 mol B
B.4 mol A、2 mol B和2 mol C
C.4 mol A和4 mol B
D.6 mol A和4 mol B
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出的热量为d kJ,则d________b(填“>”“=”或“<”)。
(5)在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,充分反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量________(填“增大”“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2.5L的恒容密闭容器中发生如下反应:CO2(g)+H2S(g)![]() COS(g)+H2O(g)
COS(g)+H2O(g)
实验 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
CO2 | H2S | H2O | |||
I | 607 | 0.11 | 0.41 | 0.01 | |
II | 607 | 0.22 | 0.82 | ||
III | 620 | 0.1 | 0.4 | 6.74×10-3 | |
下列说法不正确的是( )
A. 该反应正反应为吸热反应
B. 607K时,把物质的量均为0.1mol四种反应物加入该反应器中,反应将向正反应方向进行
C. 实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol
D. 实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)是提取铝的原料,提取铝的工艺流程如图:

请回答下列问题:
(1)过滤操作需用到的玻璃仪器除烧杯、玻璃棒外,还需要__。
(2)流程图中固体B的成分为__,流程图中试剂X为__。
(3)为验证滤液A含Fe3+,可取少量滤液A滴加__溶液,溶液显红色。
(4)通入过量的CO2时发生的化学方程式为__。
(5)现有102 t含氧化铝50%的铝土矿,理论上可炼出__t金属铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验的说法正确的是![]()
实验目的 | 实验方案 | |
A | 除去苯中溶有的苯酚 | 取苯与苯酚的混合液,加入浓溴水,过滤 |
B | 证明 | 将 |
C | 分离 | 将混合液倒入过滤器中过滤 |
D | 酸性: |
|
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com