
【题目】铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)是提取铝的原料,提取铝的工艺流程如图:

请回答下列问题:
(1)过滤操作需用到的玻璃仪器除烧杯、玻璃棒外,还需要__。
(2)流程图中固体B的成分为__,流程图中试剂X为__。
(3)为验证滤液A含Fe3+,可取少量滤液A滴加__溶液,溶液显红色。
(4)通入过量的CO2时发生的化学方程式为__。
(5)现有102 t含氧化铝50%的铝土矿,理论上可炼出__t金属铝。
【答案】 漏斗 SiO2 氢氧化钠 KSCN NaAlO2+CO2+2H2O![]() Al(OH)3↓+NaHCO3 27
Al(OH)3↓+NaHCO3 27
【解析】铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)提取铝:铝土矿加过量盐酸溶解后,Fe2O3、Al2O3和HCl反应溶解,而SiO2和HCl不反应,不能溶解,过滤,固体B为SiO2,滤液A中含有铁离子和铝离子、氢离子,加入过量烧碱,氢离子和氢氧化钠反应生成水,铁离子和铝离子都和氢氧化钠反应生成氢氧化物沉淀,氢氧化铁不溶于氢氧化钠溶液中,但氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,向偏铝酸钠溶液通入过量CO2生成沉淀C,为偏铝酸根离子和二氧化碳发生反应生成氢氧化铝沉淀,灼烧氢氧化铝得到氧化铝,电解熔融的氧化铝可得铝,据此分析解答。
(1)过滤操作需用到的玻璃仪器有烧杯、玻璃棒、漏斗;
(2)铝土矿加过量盐酸溶解后,Fe2O3、Al2O3和HCl反应溶解,而SiO2和HCl不反应,不能溶解,过滤,固体B为SiO2,滤液A中含有铁离子和铝离子、氢离子,加入过量X后得到偏铝酸钠溶液,故X为氢氧化钠;
(3)滤液A含Fe3+,可取少量滤液A滴加KSCN溶液,溶液显红色;
(4)偏铝酸根离子和二氧化碳能发生反应生成氢氧化铝沉淀,化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
(5)现有102t含氧化铝50%的铝土矿,根据铝元素质量守恒,理论上可得铝单质:102t×50%×54/102=27t。


科目:高中化学 来源: 题型:
【题目】请根据化学动力学和化学热力学回答下列问题:
I.过氧化氢是一种重要的物质,在科学研究和生产生活中应用广泛。
利用H2O2和KbrO3反应研究瞬时反应速率(r),原理为在酸催化下,KBrO3+3H2O2==KBr+3O2↑+3H2O。资料显示:r=k·cx(KbrO3)·cy(H2O2),其中k为速率常数。在290K测得实验数据如下:
实验编号 | 1 | 2 | 3 | 4 |
c(H2O2)/(mol/L) | 1 | 1 | 2 | 4 |
c(KBrO3)/(mol/L) | 0.003 | 0.006 | 0.001 | 0.001 |
R/(mol·L-1·s-1) | 3×10-4 | 6×10-4 | 8×10-4 | 6.4×10-3 |
(1)写出H2O2的电子式____________,H2O2 可以看成二元弱酸,写出其第二步电离方程式_________________________________。
(2)根据表格数据信息,写出瞬时反应速率表达式r=______(k保留两位有效数字); 如果减缓反应速率,可采用的方法有___________ (任写两点)。
II.(3)25℃,101kpa时乙烯酮CH2CO(g)和甲烷CH4的燃烧热分别为:ΔH=-1025.1kJ/mol,ΔH=-890. 3kJ/mol,则反应2CH4(g)+2O2(g)![]() CH2CO(g) +3H2O(l)的热化学方程式为__________________。
CH2CO(g) +3H2O(l)的热化学方程式为__________________。
(4)在恒容容器中。通入2molCH4和2molO2,不能判断反应2CH4(g)+2O2(g)![]() CH2CO(g) +3H2O(l)处于平衡状态的是_________。
CH2CO(g) +3H2O(l)处于平衡状态的是_________。
体系内压强保持不变 B.体系内气体密度保持不变
C.单位时间每消耗2molCH4,同时生成lmolO2
D.通入等物质的量的反应物,一段时间后反应物浓度之比不变
(5)对于反应2CH4(g)+2O2(g)![]() CH2CO(g) +3H2O(g),在恒容条件下,向容器内加入0.1molCH4和0.1molO2,反应达到平衡时CH2CO的物质的量百分含量为15%,则平衡时n(CH4)=______ mol。
CH2CO(g) +3H2O(g),在恒容条件下,向容器内加入0.1molCH4和0.1molO2,反应达到平衡时CH2CO的物质的量百分含量为15%,则平衡时n(CH4)=______ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四种仪器装置的用法,不合理的是
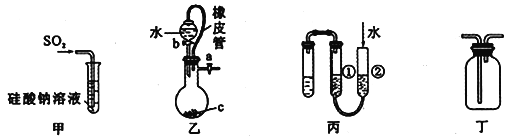
A. 甲装置:可用来证明硫的非金属性比硅强
B. 乙装置:橡皮管的作用是能使水顺利流下
C. 丙装置:用图示的方法能检查此装置的气密性
D. 丁装置:可在瓶中先装入某种液体收集NO气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中可用来设计成原电池的是( )
A. CaO +H2O===Ca(OH)2 B. NaOH+HCl===NaCl+H2O
C. 2KClO3![]() 2KCl+3O2↑ D. Zn+2HCl===ZnCl2+H2↑
2KCl+3O2↑ D. Zn+2HCl===ZnCl2+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置处理含NO3﹣的酸性工业废水,某电极反应式为2NO3﹣+12H++10e﹣=N2+6H2O,则下列说法错误的( ) 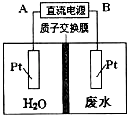
A.电源正极为A,电解过程中有气体放出
B.电解时H+从质子交换膜左侧向右侧移动
C.电解过程中,右侧电解液pH保持不变
D.电解池一侧生成5.6g N2 , 另一侧溶液质量减少l8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物有着优异的性能和广泛的应用。工业上利用铅浮渣(主要成分是PbO、Pb还含有少量的Ag、CaO) 可制备硫酸铅。制备流程图如下:

已知: Ksp(PbSO4)=1.6×10-8Ksp(CaSO4)=4.9×10-5
(1)步骤I有NO产生,浸出液中含量最多的金属阳离子为Pb2+,写出Pb参加反应的化学方程式__________________,为防止Ag被溶解进入溶液,步骤I操作时应注意____________。
(2)粗PbSO4产品含有的杂质是________;要得到纯净的PbSO4,需要用试剂进行多次洗涤,再用蒸馏水洗涤。最好选用的试剂是__________________。
A.稀硫酸 B.稀盐酸 C.硝酸铅溶液 D.酒精
(3)母液可循环利用的物质是HNO3,若母液中残留的SO42-过多,循环利用时可能出现的问题是_____________________。
(4)若将步骤II中的Pb2+完全沉淀,则溶液中的c(SO42-)至少为_____mol/L。
(5)(CH3COO)2Pb是皮毛行业的染色助剂,可用PbSO4 与CH3COONH4反应制备,写出反应的离子方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应热和焓变的单位都是 kJ
B.相同条件下,生成物的总能量大于反应物的总能量时,反应吸热,ΔH>0
C.在任何条件下,化学反应的焓变都等于化学反应的反应热
D.任何化学反应的反应热均可通过实验直接测定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙是周期表中同一主族的两种元素,若甲的原子序数为 x,则乙的原子序数不可能为( )
①x+2 ②x+4 ③x+16 ④x+26 ⑤x+32
A.①⑤B.②C.③D.④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com