
【题目】请根据化学动力学和化学热力学回答下列问题:
I.过氧化氢是一种重要的物质,在科学研究和生产生活中应用广泛。
利用H2O2和KbrO3反应研究瞬时反应速率(r),原理为在酸催化下,KBrO3+3H2O2==KBr+3O2↑+3H2O。资料显示:r=k·cx(KbrO3)·cy(H2O2),其中k为速率常数。在290K测得实验数据如下:
实验编号 | 1 | 2 | 3 | 4 |
c(H2O2)/(mol/L) | 1 | 1 | 2 | 4 |
c(KBrO3)/(mol/L) | 0.003 | 0.006 | 0.001 | 0.001 |
R/(mol·L-1·s-1) | 3×10-4 | 6×10-4 | 8×10-4 | 6.4×10-3 |
(1)写出H2O2的电子式____________,H2O2 可以看成二元弱酸,写出其第二步电离方程式_________________________________。
(2)根据表格数据信息,写出瞬时反应速率表达式r=______(k保留两位有效数字); 如果减缓反应速率,可采用的方法有___________ (任写两点)。
II.(3)25℃,101kpa时乙烯酮CH2CO(g)和甲烷CH4的燃烧热分别为:ΔH=-1025.1kJ/mol,ΔH=-890. 3kJ/mol,则反应2CH4(g)+2O2(g)![]() CH2CO(g) +3H2O(l)的热化学方程式为__________________。
CH2CO(g) +3H2O(l)的热化学方程式为__________________。
(4)在恒容容器中。通入2molCH4和2molO2,不能判断反应2CH4(g)+2O2(g)![]() CH2CO(g) +3H2O(l)处于平衡状态的是_________。
CH2CO(g) +3H2O(l)处于平衡状态的是_________。
体系内压强保持不变 B.体系内气体密度保持不变
C.单位时间每消耗2molCH4,同时生成lmolO2
D.通入等物质的量的反应物,一段时间后反应物浓度之比不变
(5)对于反应2CH4(g)+2O2(g)![]() CH2CO(g) +3H2O(g),在恒容条件下,向容器内加入0.1molCH4和0.1molO2,反应达到平衡时CH2CO的物质的量百分含量为15%,则平衡时n(CH4)=______ mol。
CH2CO(g) +3H2O(g),在恒容条件下,向容器内加入0.1molCH4和0.1molO2,反应达到平衡时CH2CO的物质的量百分含量为15%,则平衡时n(CH4)=______ mol。
【答案】 ![]() HO2-
HO2-![]() O22-+H+ r=0.1·c3(H2O2)·c(KBrO3) 骤冷、冲稀反应物、除去催化剂、加阻化剂等两项 2CH4(g)+2O2(g)=CH2CO(g)+3H2O(1) ΔH=-755.5kJ/mol AB 0.04
O22-+H+ r=0.1·c3(H2O2)·c(KBrO3) 骤冷、冲稀反应物、除去催化剂、加阻化剂等两项 2CH4(g)+2O2(g)=CH2CO(g)+3H2O(1) ΔH=-755.5kJ/mol AB 0.04
【解析】I.(1)H2O2为共价化合物,电子式![]() ;H2O2可以看成二元弱酸,分步电离,H2O2
;H2O2可以看成二元弱酸,分步电离,H2O2![]() HO2-+ H+ ,HO2-
HO2-+ H+ ,HO2-![]() O22-+H+ ;正确答案:
O22-+H+ ;正确答案:![]() ;HO2-
;HO2-![]() O22-+H+。
O22-+H+。
(2)根据表格中数据可知,当c(H2O2)= 1 mol/L时,根据r=k·cx(KbrO3)·cy(H2O2)可知:3×10-4/6×10-4=(0.003/0.006)a,a=1;当c(KBrO3)=0.001 mol/L时,根据r=k·cx(KbrO3)·cy(H2O2)可知:8×10-4/6.4×10-3=(2/4)b,b=3;根据r=k·c(KbrO3)·c3(H2O2)可知,3×10-4= k×0.003×12,k=0.1;所以瞬时反应速率表达式r==0.1·c3(H2O2)·c(KBrO3);如果减缓反应速率,可采用的方法有骤冷、冲稀反应物、除去催化剂、加阻化剂等两项;正确答案:r=0.1·c3(H2O2)·c(KBrO3) ; 骤冷、冲稀反应物、除去催化剂、加阻化剂等两项。
II.(3)①CH2CO(g)+2O2(g)=2CO2(g)+H2O(l),ΔH=-1025.1kJ/mol;② CH4(g) +2O2(g)=CO2(g)+2H2O(l), ΔH=-890.3kJ/mol;根据盖斯定律:②×2-①,得2CH4(g)+2O2(g)![]() CH2CO(g)+3H2O(l),ΔH=-755.5kJ/mol;正确答案:2CH4(g)+2O2(g)=CH2CO(g)+3H2O(1)ΔH=-755.5kJ/mol。
CH2CO(g)+3H2O(l),ΔH=-755.5kJ/mol;正确答案:2CH4(g)+2O2(g)=CH2CO(g)+3H2O(1)ΔH=-755.5kJ/mol。
(4)该反应正反应为气体体积减小的可逆反应,在恒容容器中,压强不再发生变化,能判定反应达平衡状态,A正确;反应后气体的总质量减小,容器的总体积不变,气体的密度不再发生变化,能判定反应达平衡状态,B正确;单位时间每消耗2molCH4,反应向右进行;同时生成2molO2,反应向左进行,反应达平衡状态,C错误;按反应物的系数比加入反应物,无论反应进行到什么程度,反应物浓度之比不变,不能判断反应是否达平衡状态,D错误;正确选项AB。
(5) 设甲烷的变化量为xmol,根据方程式进行计算
2CH4(g)+2O2(g)![]() CH2CO(g)+3H2O(g),
CH2CO(g)+3H2O(g),
起始量 0.1 0.1 0 0
变化量 x x 0.5x 1.5x
平衡量 0.1-x 0.1-x 0.5x 1.5x
根据反应达到平衡时CH2CO的物质的量百分含量为15%,列方程为:0.5x/(0.1-x+0.1-x+0.5x+1.5x)= 15% x=0.06mol,所以则平衡时n(CH4)=0.04mol;正确答案:0.04。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 煤经气化和液化这两个物理过程,可变为清洁能源
B.石油分馏可获得乙酸、苯及其衍生物
C.通过石油的裂化可以得到乙烯、丙烯等重要化工基本原料
D.煤干馏可转化为焦炉气、煤焦油、焦炭等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞化学成分的叙述中,正确的是( )
A. 肝脏细胞中含量最多的化合物是糖原
B. RNA分子中也有糖类物质
C. DNA的多样性和特异性取决于核苷酸的种类、数量和排列顺序
D. 当生物体内的结合水与自由水的比值升高时,生物体的新陈代谢旺盛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在番茄幼苗的培养液中,除了必需的微量元素、NH4+、P043-和C02外,还必需的大量元素有( )
A. C、H、O、N
B. K、Ca、Mg、Fe
C. Mn、Mo、Cu、Zn
D. K、Ca、Mg、S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地球上海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg/L。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入富含溴离子的海水中,把溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及的反应有
①______________(写出离子方程式);
②3Br2+3CO32-===![]() +5Br+3CO2;
+5Br+3CO2;
③![]() +5Br+6H+===3Br2+3H2O。
+5Br+6H+===3Br2+3H2O。
其中反应②中氧化剂是________,还原剂是________。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫反应的化学方程式:_______________。
(3)溶剂萃取法。该法是利用单质溴在水中和有机溶剂中溶解度不同的原理来进行的。实验室中萃取用到的实验仪器名称是________。下列可以用于海水中溴的萃取的溶剂是_______(填序号)。
①乙醇 ②四氯化碳 ③硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
(1)实验目的:制取乙酸乙酯。
(2)实验原理:甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,反应的方程式为______________;其中浓硫酸的作用是______________。
(3)装置设计:甲、乙、丙三位同学分别设计下列三套实验装置。
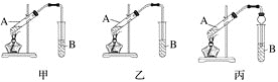
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是______________(选填“甲”或“乙”);丙同学将甲装置中的玻璃管改成球形干燥管,除起冷凝作用外,另一重要作用是___________________________。
(4)实验步骤:
①按我选择的装置仪器,在试管中先加入2mL浓硫酸,缓缓加入3mL乙醇充分摇匀,冷却后再加入2mL冰醋酸;
②将试管固定在铁架台上;
③在试管B中加入适量的饱和碳酸钠溶液;
④用酒精灯对试管A加热;
⑤当观察到试管B中有明显现象时停止实验。
你认为实验操作中存在的错误有____________________________________________。
(5)问题讨论:
①试管B中饱和碳酸钠溶液的作用是_________________________________________。
②从试管B中分离出乙酸乙酯的实验操作是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊都是单质,其中甲、乙、丙是常见金属,丁和戊是气体,且丁呈黄绿色.A~K是化合物.F是红褐色沉淀,G是淡黄色固体粉末,D的溶液是蓝色的,K是丁的气态氢化物.已知乙和丙在周期表中位于同一周期,且丙原子最外能层电子构型为ns1 . 它们之间有如图的转化关系(部分反应物或产物省略). 
回答以下问题:
(1)G的电子式:
(2)甲基态原子的电子排布式为 , 与同周期的金属元素相比,第一电离能由小到大的顺序是(用元素符号表示).
(3)反应②的离子方程式: .
(4)乙的高价阳离子的最高能级电子排布图为: . 检验该离子常用KSCN溶液.丙的外围电子排布式为 , 在元素周期表中的位置为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)是提取铝的原料,提取铝的工艺流程如图:

请回答下列问题:
(1)过滤操作需用到的玻璃仪器除烧杯、玻璃棒外,还需要__。
(2)流程图中固体B的成分为__,流程图中试剂X为__。
(3)为验证滤液A含Fe3+,可取少量滤液A滴加__溶液,溶液显红色。
(4)通入过量的CO2时发生的化学方程式为__。
(5)现有102 t含氧化铝50%的铝土矿,理论上可炼出__t金属铝。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com