
【题目】在番茄幼苗的培养液中,除了必需的微量元素、NH4+、P043-和C02外,还必需的大量元素有( )
A. C、H、O、N
B. K、Ca、Mg、Fe
C. Mn、Mo、Cu、Zn
D. K、Ca、Mg、S
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关. 已知:H2(g)+Cl2(g)═2HCl(g)△H=﹣185kJ/mol
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol
则E(H﹣Cl)= .
(2)纳米级Cu2O由于具有优良的催化性能而受到关注.已知: 2Cu(s)+ ![]() O2(g)═Cu2O(s)△H=﹣169kJmol﹣1 ,
O2(g)═Cu2O(s)△H=﹣169kJmol﹣1 ,
C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1 ,
O2(g)═CO(g)△H=﹣110.5kJmol﹣1 ,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为 .
(3)如图是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同状况下,1体积某气态烃只能与1体积Cl2发生加成反应,生成氯代烷,1 mol此氯代烷可与4 mol Cl2发生完全取代反应,则该烃的结构简式为( )
A. CH2===CH2 B. CH3CH===CH2
C. CH3CH3 D. CH2===CH—CH===CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究外界条件对反应aX(g)+bY(g)cZ(g)的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.以下判断正确的是( ) 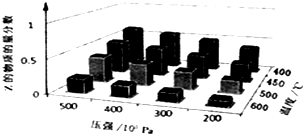
A.△H>0,a+b>c
B.△H>0,a+b<c
C.△H<0,a+b>c
D.△H<0,a+b<c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

(1)氢氧燃料电池能量转化的主要形式是____________________________________________,在导线中电子流动方向为________(用a、b表示)。
(2)负极反应式为________________________________________________________________。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2===2LiH Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是________。
②金属锂吸收的氢气与放出的氢气的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据化学动力学和化学热力学回答下列问题:
I.过氧化氢是一种重要的物质,在科学研究和生产生活中应用广泛。
利用H2O2和KbrO3反应研究瞬时反应速率(r),原理为在酸催化下,KBrO3+3H2O2==KBr+3O2↑+3H2O。资料显示:r=k·cx(KbrO3)·cy(H2O2),其中k为速率常数。在290K测得实验数据如下:
实验编号 | 1 | 2 | 3 | 4 |
c(H2O2)/(mol/L) | 1 | 1 | 2 | 4 |
c(KBrO3)/(mol/L) | 0.003 | 0.006 | 0.001 | 0.001 |
R/(mol·L-1·s-1) | 3×10-4 | 6×10-4 | 8×10-4 | 6.4×10-3 |
(1)写出H2O2的电子式____________,H2O2 可以看成二元弱酸,写出其第二步电离方程式_________________________________。
(2)根据表格数据信息,写出瞬时反应速率表达式r=______(k保留两位有效数字); 如果减缓反应速率,可采用的方法有___________ (任写两点)。
II.(3)25℃,101kpa时乙烯酮CH2CO(g)和甲烷CH4的燃烧热分别为:ΔH=-1025.1kJ/mol,ΔH=-890. 3kJ/mol,则反应2CH4(g)+2O2(g)![]() CH2CO(g) +3H2O(l)的热化学方程式为__________________。
CH2CO(g) +3H2O(l)的热化学方程式为__________________。
(4)在恒容容器中。通入2molCH4和2molO2,不能判断反应2CH4(g)+2O2(g)![]() CH2CO(g) +3H2O(l)处于平衡状态的是_________。
CH2CO(g) +3H2O(l)处于平衡状态的是_________。
体系内压强保持不变 B.体系内气体密度保持不变
C.单位时间每消耗2molCH4,同时生成lmolO2
D.通入等物质的量的反应物,一段时间后反应物浓度之比不变
(5)对于反应2CH4(g)+2O2(g)![]() CH2CO(g) +3H2O(g),在恒容条件下,向容器内加入0.1molCH4和0.1molO2,反应达到平衡时CH2CO的物质的量百分含量为15%,则平衡时n(CH4)=______ mol。
CH2CO(g) +3H2O(g),在恒容条件下,向容器内加入0.1molCH4和0.1molO2,反应达到平衡时CH2CO的物质的量百分含量为15%,则平衡时n(CH4)=______ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.可能存在核外电子排布式为1s22s22p63s23p64s24p1的原子
B.当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相反
C.次氯酸的电子式: ![]()
D.基态原子的电子获得一定能量变为激发态原子,而激发态原子变为基态原子,则要放出能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中可用来设计成原电池的是( )
A. CaO +H2O===Ca(OH)2 B. NaOH+HCl===NaCl+H2O
C. 2KClO3![]() 2KCl+3O2↑ D. Zn+2HCl===ZnCl2+H2↑
2KCl+3O2↑ D. Zn+2HCl===ZnCl2+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com