
【题目】为了探究外界条件对反应aX(g)+bY(g)cZ(g)的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.以下判断正确的是( ) 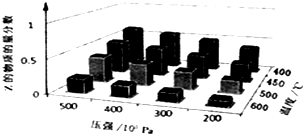
A.△H>0,a+b>c
B.△H>0,a+b<c
C.△H<0,a+b>c
D.△H<0,a+b<c
科目:高中化学 来源: 题型:
【题目】下列解释实验过程或事实的反应方程式不正确的是
A. 熔融烧碱时,不能使用氧化铝坩埚:Al2O3+2NaOH![]() 2NaAlO2+H2O
2NaAlO2+H2O
B. 刻制印刷电路时用FeCl3溶液作为“腐蚀液”:2Fe3++Cu=Cu2++2Fe2+
C. 打磨后的镁条置于沸水中,滴加酚酞溶液变红色:Mg+2H2O(g)![]() Mg(OH)2+H2↑
Mg(OH)2+H2↑
D. 向KI溶液中滴加硫酸酸化的双氧水,溶液呈棕黄色:2I﹣+H2O2+2H+=I2+O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2O2说法正确的是( )
A. Na2O2与CO2反应,产生标准状况下2.24LO2,转移0.2×6.02×1023个电子
B. Na2O2中只含有离子键
C. Na2O2中阴阳离子的个数比为1:1
D. Na2O2由钠在常温下与氧气反应得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞化学成分的叙述中,正确的是( )
A. 肝脏细胞中含量最多的化合物是糖原
B. RNA分子中也有糖类物质
C. DNA的多样性和特异性取决于核苷酸的种类、数量和排列顺序
D. 当生物体内的结合水与自由水的比值升高时,生物体的新陈代谢旺盛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在番茄幼苗的培养液中,除了必需的微量元素、NH4+、P043-和C02外,还必需的大量元素有( )
A. C、H、O、N
B. K、Ca、Mg、Fe
C. Mn、Mo、Cu、Zn
D. K、Ca、Mg、S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
(1)实验目的:制取乙酸乙酯。
(2)实验原理:甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,反应的方程式为______________;其中浓硫酸的作用是______________。
(3)装置设计:甲、乙、丙三位同学分别设计下列三套实验装置。
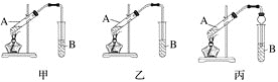
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是______________(选填“甲”或“乙”);丙同学将甲装置中的玻璃管改成球形干燥管,除起冷凝作用外,另一重要作用是___________________________。
(4)实验步骤:
①按我选择的装置仪器,在试管中先加入2mL浓硫酸,缓缓加入3mL乙醇充分摇匀,冷却后再加入2mL冰醋酸;
②将试管固定在铁架台上;
③在试管B中加入适量的饱和碳酸钠溶液;
④用酒精灯对试管A加热;
⑤当观察到试管B中有明显现象时停止实验。
你认为实验操作中存在的错误有____________________________________________。
(5)问题讨论:
①试管B中饱和碳酸钠溶液的作用是_________________________________________。
②从试管B中分离出乙酸乙酯的实验操作是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠化学式为NaCN(C元素+2价,N元素-3价),氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是____________________________________________。
(2)氰化钠与硫代硫酸钠的反应为:NaCN+Na2S2O3═NaSCN+Na2SO3;已知:NaSCN中S为-2价,写出SCN-的电子式___________。
(3)CN-中C元素显+2价,N元素显-3价,说明非金属性N>C,请设计实验证明:_____________。
(4)同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①向NaCN溶液中通入少量CO2,发生的离子反应为_______________________________。
②等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数的关系是:HCOONa______NaCN。(填“>”、“<”或“=”)
(5)常温下,用0.10mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。

①常温时醋酸的电离常数为1.96×10-5,0.10 mol·L-1CH3COOH溶液中c(H+)=__________mol·L-1。
②在①所示的溶液中溶质为_____
③在①和②所示溶液中c(CH3COO-)-c(CN-)_______(填“>”、“<”或“=”)c(HCN)-c(CH3COOH)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com