
����Ŀ�������Ǽס��ҡ�����λͬѧ��ȡ���������Ĺ��̣�������벢Э������������ʵ������
(1)ʵ��Ŀ�ģ���ȡ����������
(2)ʵ��ԭ�����ס��ҡ�����λͬѧ����ȡ�Ҵ���������Ũ�����Ϲ��ȵķ�����ȡ������������Ӧ�ķ���ʽΪ______________������Ũ�����������______________��
(3)װ����ƣ��ס��ҡ�����λͬѧ�ֱ������������ʵ��װ�á�
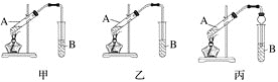
��Ӽס�����λͬѧ��Ƶ�װ����ѡ��һ����Ϊʵ������ȡ����������װ�ã���ѡ���װ����______________(ѡ��ס����ҡ�)����ͬѧ����װ���еIJ����ܸij����θ���ܣ��������������⣬��һ��Ҫ������___________________________��
(4)ʵ�鲽�裺
�ٰ���ѡ���װ�����������Թ����ȼ���2mLŨ���ᣬ��������3mL�Ҵ����ҡ�ȣ���ȴ���ټ���2mL�����
�ڽ��Թ̶ܹ�������̨�ϣ�
�����Թ�B�м��������ı���̼������Һ��
���þƾ��ƶ��Թ�A���ȣ�
�ݵ��۲쵽�Թ�B������������ʱֹͣʵ�顣
����Ϊʵ������д��ڵĴ�����____________________________________________��
(5)�������ۣ�
���Թ�B�б���̼������Һ��������_________________________________________��
�ڴ��Թ�B�з��������������ʵ�������______________________________��
���𰸡� CH3COOH��C2H5OH![]() CH3COOC2H5��H2O ��������ˮ�� �� ��ֹ���� ʵ�鲽�����û���ȼ��װ�õ������ԣ�Ӧ�ȼ����Ҵ����ٻ�������Ũ���� �ܽ��ȥ������Ҵ������������������ܽ�� ��Һ
CH3COOC2H5��H2O ��������ˮ�� �� ��ֹ���� ʵ�鲽�����û���ȼ��װ�õ������ԣ�Ӧ�ȼ����Ҵ����ٻ�������Ũ���� �ܽ��ȥ������Ҵ������������������ܽ�� ��Һ
����������2���Ҵ������ᷢ��������Ӧ��������������H2O����Ӧ�Ļ�ѧ����ʽΪCH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O������Ũ����������ǣ���������ˮ����
CH3COOCH2CH3+H2O������Ũ����������ǣ���������ˮ����
��3���Աȼ�װ�ú���װ�ã���װ���е����ܿ�����B��Һ���£��������������ѡ���װ�����ҡ���ͬѧ����װ���в����ܸij����θ���ܣ��������������⣬��һ��Ҫ�����ǣ���ֹ������
��4��ʵ������д��ڵĴ����У�ʵ�鲽������û���ȼ��װ�õ������ԣ���������Ӧ�ȼ����Ҵ����ٻ�������Ũ������
��5�����Թ�B�б���̼������Һ�����������ܽ��ȥ�Ҵ������ᣬ���������������ܽ�ȡ�
�����Թ�B�з��������������ʵ������ǣ���Һ��
��2���Ҵ������ᷢ��������Ӧ��������������H2O����Ӧ�Ļ�ѧ����ʽΪCH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O������Ũ����������ǣ���������ˮ����
CH3COOCH2CH3+H2O������Ũ����������ǣ���������ˮ����
��3���Աȼ�װ�ú���װ�ã���װ���е����ܿ�����B��Һ���£��������������ѡ���װ�����ҡ���ͬѧ����װ���в����ܸij����θ���ܣ��������������⣬��һ��Ҫ�����ǣ���ֹ������
��4��ʵ������д��ڵĴ����У�ʵ�鲽������û���ȼ��װ�õ������ԣ���������Ӧ�ȼ����Ҵ����ٻ�������Ũ������
��5�����Թ�B�б���̼������Һ�����������ܽ��ȥ�Ҵ������ᣨ��ˮ�����Ҵ���Na2CO3�����ᷴӦ����CH3COONa��H2O��CO2�������������������ܽ�ȡ�
������������������ˮ���ܶȱ�ˮС��Һ�壬�Թ�B�г��ֲַ������Թ�B�з��������������ʵ������ǣ���Һ��


 �ݾ�ѵ������ϵ�д�
�ݾ�ѵ������ϵ�д� С����ȫ�ܼ��ϵ�д�
С����ȫ�ܼ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ����ͨ��CaCl2��Һ�У��л���������� (����)
A.SO2B.NaHCO3C.SO3D.CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽����������Է�ӦaX��g��+bY��g��cZ��g����Ӱ�죬��X��Y���ʵ�����Ϊa��b��ʼ��Ӧ��ͨ��ʵ��õ���ͬ�����´ﵽƽ��ʱZ�����ʵ���������ʵ������ͼ��ʾ�������ж���ȷ���ǣ������� 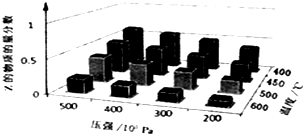
A.��H��0��a+b��c
B.��H��0��a+b��c
C.��H��0��a+b��c
D.��H��0��a+b��c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ�����ش�

��1������ȼ�ϵ������ת������Ҫ��ʽ��____________________________________________���ڵ����е�����������Ϊ________(��a��b��ʾ)��
��2��������ӦʽΪ________________________________________________________________��
��3���õ�ع���ʱ��H2��O2�������ⲿ��������ؿ����������ṩ���ܣ�������ȫ�����ǹؼ�����֮һ���������һ����Ҫ�Ĵ�����ϣ�����ͷ���ԭ�����£�
��.2Li��H2===2LiH����.LiH��H2O===LiOH��H2��
�ٷ�Ӧ���еĻ�ԭ����________����Ӧ���е���������________��
�ڽ�������յ�������ų������������ʵ���֮��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ݻ�ѧ����ѧ�ͻ�ѧ����ѧ�ش���������:
I.����������һ����Ҫ�����ʣ��ڿ�ѧ�о�������������Ӧ�ù㷺��
����H2O2��KbrO3��Ӧ�о�˲ʱ��Ӧ����(r)��ԭ��Ϊ������£�KBrO3+3H2O2==KBr+3O2��+3H2O��������ʾ:r=k��cx(KbrO3)��cy(H2O2)������kΪ���ʳ�������290K���ʵ����������:
ʵ���� | 1 | 2 | 3 | 4 |
c(H2O2)/(mol/L) | 1 | 1 | 2 | 4 |
c(KBrO3)/(mol/L) | 0.003 | 0.006 | 0.001 | 0.001 |
R/(mol��L-1��s-1) | 3��10-4 | 6��10-4 | 8��10-4 | 6.4��10-3 |
(1)д��H2O2�ĵ���ʽ____________��H2O2 ���Կ��ɶ�Ԫ���ᣬд����ڶ������뷽��ʽ_________________________________��
(2)���ݱ���������Ϣ��д��˲ʱ��Ӧ���ʱ���ʽr=______(k������λ��Ч����); ���������Ӧ���ʣ��ɲ��õķ�����___________ (��д����)��
II.(3)25�棬101kpaʱ��ϩͪCH2CO(g)�ͼ���CH4��ȼ���ȷֱ�Ϊ:��H=-1025.1kJ/mol����H=-890. 3kJ/mol����Ӧ2CH4(g)+2O2(g)![]() CH2CO(g) +3H2O(l)���Ȼ�ѧ����ʽΪ__________________��
CH2CO(g) +3H2O(l)���Ȼ�ѧ����ʽΪ__________________��
(4)�ں��������С�ͨ��2molCH4��2molO2�������жϷ�Ӧ2CH4(g)+2O2(g)![]() CH2CO(g) +3H2O(l)����ƽ��״̬����_________��
CH2CO(g) +3H2O(l)����ƽ��״̬����_________��
��ϵ��ѹǿ���ֲ��� B.��ϵ�������ܶȱ��ֲ���
C.��λʱ��ÿ����2molCH4��ͬʱ����lmolO2
D.ͨ������ʵ����ķ�Ӧ�һ��ʱ���Ӧ��Ũ��֮�Ȳ���
(5)���ڷ�Ӧ2CH4(g)+2O2(g)![]() CH2CO(g) +3H2O(g)���ں��������£��������ڼ���0.1molCH4��0.1molO2����Ӧ�ﵽƽ��ʱCH2CO�����ʵ����ٷֺ���Ϊ15%����ƽ��ʱn(CH4)=______ mol��
CH2CO(g) +3H2O(g)���ں��������£��������ڼ���0.1molCH4��0.1molO2����Ӧ�ﵽƽ��ʱCH2CO�����ʵ����ٷֺ���Ϊ15%����ƽ��ʱn(CH4)=______ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ա����ж���ҽԺ�г������ᱵ���ֱ�����Ϊ�ڷ���Ӱ����ҽԺ���ȱ������ж�����ʱ���������⣬����Ҫ���ж���θ�й�����������Һ����֪��ij�¶��£�Ksp��BaCO3��=5.1��10��9 mol2L��2��Ksp��BaSO4��=1.1��10��10 mol2L��2�����ƶ���ȷ���ǣ�������
A.����̼�ᱵ��Ϊ�ڷ���Ӱ��������ΪKsp��BaCO3����Ksp��BaSO4��
B.���ȱ������ж�����ʱ����û�������ƣ�������̼������Һ����
C.������c��Ba2+��=1.0��10��5 molL��1����Һʱ�������������ж�
D.������0.36 molL��1��Na2SO4��Һ���������ж�����ϴθ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ�������
A.���ܴ��ں�������Ų�ʽΪ1s22s22p63s23p64s24p1��ԭ��
B.�������Ų���ͬһ�ܼ��IJ�ͬ���ʱ���������ȵ���ռ��һ��������������������෴
C.������ĵ���ʽ�� ![]()
D.��̬ԭ�ӵĵ��ӻ��һ��������Ϊ����̬ԭ�ӣ�������̬ԭ�ӱ�Ϊ��̬ԭ�ӣ���Ҫ�ų�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڼ����������ȷ���ǣ� ��
A.������ӵ����幹�����������壬���ԣ�CH2Cl2�����ֲ�ͬ����
B.�����������������ȡ����Ӧ����ˣ�����ʹ��ˮ��ɫ
C.������ʹ����KMnO4��Һ��ɫ
D.�����ܹ�ȼ�գ���һ�������»ᷢ����ը����ˣ��ǿ�ȫ����Ҫ��в֮һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ���仯����������������ܺ㷺��Ӧ�á���ҵ������Ǧ����(��Ҫ�ɷ���PbO��Pb������������Ag��CaO) ���Ʊ�����Ǧ���Ʊ�����ͼ����:

��֪: Ksp(PbSO4)=1.6��10-8Ksp(CaSO4)=4.9��10-5
��1������I��NO����������Һ�к������Ľ���������ΪPb2+��д��Pb�μӷ�Ӧ�Ļ�ѧ����ʽ__________________��Ϊ��ֹAg���ܽ������Һ������I����ʱӦע��____________��
��2����PbSO4��Ʒ���е�������________��Ҫ�õ�������PbSO4����Ҫ���Լ����ж��ϴ������������ˮϴ�ӡ����ѡ�õ��Լ���__________________��
A.ϡ���� B.ϡ���� C.����Ǧ��Һ D.�ƾ�
��3��ĸҺ��ѭ�����õ�������HNO3����ĸҺ�в�����SO42-���࣬ѭ������ʱ���ܳ��ֵ�������_____________________��
��4����������II�е�Pb2+��ȫ����,����Һ�е�c(SO42-)����Ϊ_____mol/L��
��5��(CH3COO)2Pb��Ƥë��ҵ��Ⱦɫ����������PbSO4 ��CH3COONH4��Ӧ�Ʊ���д����Ӧ�����ӷ���ʽ_________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com