
【题目】下列关于甲烷的叙述正确的是( )
A.甲烷分子的立体构型是正四面体,所以,CH2Cl2有两种不同构型
B.甲烷可以与氯气发生取代反应,因此,可以使氯水褪色
C.甲烷能使酸性KMnO4溶液褪色
D.甲烷能够燃烧,在一定条件下会发生爆炸,因此,是矿井安全的重要威胁之一
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关Na2O2说法正确的是( )
A. Na2O2与CO2反应,产生标准状况下2.24LO2,转移0.2×6.02×1023个电子
B. Na2O2中只含有离子键
C. Na2O2中阴阳离子的个数比为1:1
D. Na2O2由钠在常温下与氧气反应得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
(1)实验目的:制取乙酸乙酯。
(2)实验原理:甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,反应的方程式为______________;其中浓硫酸的作用是______________。
(3)装置设计:甲、乙、丙三位同学分别设计下列三套实验装置。
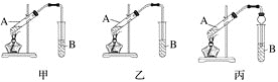
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是______________(选填“甲”或“乙”);丙同学将甲装置中的玻璃管改成球形干燥管,除起冷凝作用外,另一重要作用是___________________________。
(4)实验步骤:
①按我选择的装置仪器,在试管中先加入2mL浓硫酸,缓缓加入3mL乙醇充分摇匀,冷却后再加入2mL冰醋酸;
②将试管固定在铁架台上;
③在试管B中加入适量的饱和碳酸钠溶液;
④用酒精灯对试管A加热;
⑤当观察到试管B中有明显现象时停止实验。
你认为实验操作中存在的错误有____________________________________________。
(5)问题讨论:
①试管B中饱和碳酸钠溶液的作用是_________________________________________。
②从试管B中分离出乙酸乙酯的实验操作是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.
(1)利用金属钠和CO2反应可制备金刚石,其相关反应的热化学方程式如下: 4Na(g)+3CO2(g)═2Na2CO3(l)+C(s,金刚石)△H=a kJmol﹣1
CO2(g)+4Na(g)═2Na2O(s)+C(s,金刚石)△H=b kJmol﹣1
反应6Na2O(s)+2C(s,金刚石)═8Na(g)+2Na2CO3(l)的△H=kJmol﹣1(用含a、b的代数式表示).
(2)T℃时,体积为2L的恒容容器中加入一定量的Na2SO4固体和氢气,发生如下反应: Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g).
①若降低温度,K值减小,则反应的△H0(填“>或“<”).
②下列说法错误的是 .
A.增加Na2SO4(s)的量可加快反应速率
B.当混合气体的密度一定时,该反应达到平衡状态
C.保持温度不变,向平衡体系中再通入一定量的H2 , △H不变
D.其他条件不变,升高温度,则v(正)增大,v(逆)减小,平衡右移
③若2min内反应达到平衡,此时气体质量增加了8g,则用H2表示的反应速率为;已知反应过程中H2的体积分数与时间的关系如上图所示,则T℃下该反应的平衡常数为 .
④若反应达平衡后,加入一定量的H2 , 再次平衡后H2O的体积分数(填“增大”“减小”或“不变”).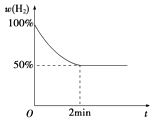
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊都是单质,其中甲、乙、丙是常见金属,丁和戊是气体,且丁呈黄绿色.A~K是化合物.F是红褐色沉淀,G是淡黄色固体粉末,D的溶液是蓝色的,K是丁的气态氢化物.已知乙和丙在周期表中位于同一周期,且丙原子最外能层电子构型为ns1 . 它们之间有如图的转化关系(部分反应物或产物省略). 
回答以下问题:
(1)G的电子式:
(2)甲基态原子的电子排布式为 , 与同周期的金属元素相比,第一电离能由小到大的顺序是(用元素符号表示).
(3)反应②的离子方程式: .
(4)乙的高价阳离子的最高能级电子排布图为: . 检验该离子常用KSCN溶液.丙的外围电子排布式为 , 在元素周期表中的位置为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯、乙炔、甲苯、苯乙烯( ![]() )4种有机物分别在一定条件下与H2充分反应. ①若烃与H2完全加成反应时的物质的量之比为1:3,它是 .
)4种有机物分别在一定条件下与H2充分反应. ①若烃与H2完全加成反应时的物质的量之比为1:3,它是 .
②若烃与H2完全加成反应时的物质的量之比为1:2,它是 .
③苯乙烯与H2完全加成的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠化学式为NaCN(C元素+2价,N元素-3价),氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是____________________________________________。
(2)氰化钠与硫代硫酸钠的反应为:NaCN+Na2S2O3═NaSCN+Na2SO3;已知:NaSCN中S为-2价,写出SCN-的电子式___________。
(3)CN-中C元素显+2价,N元素显-3价,说明非金属性N>C,请设计实验证明:_____________。
(4)同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①向NaCN溶液中通入少量CO2,发生的离子反应为_______________________________。
②等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数的关系是:HCOONa______NaCN。(填“>”、“<”或“=”)
(5)常温下,用0.10mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。

①常温时醋酸的电离常数为1.96×10-5,0.10 mol·L-1CH3COOH溶液中c(H+)=__________mol·L-1。
②在①所示的溶液中溶质为_____
③在①和②所示溶液中c(CH3COO-)-c(CN-)_______(填“>”、“<”或“=”)c(HCN)-c(CH3COOH)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知对于电离常数为Ka的某一元弱酸滴定过程中,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法不正确的是

A. 由图可知,c1>c2>c3
B. M点溶液中存在:c(H+)+c(HA)=c(OH-)+c(A-)
C. 恰好中和时,溶液中离子浓度的大小关系: c(Na+)>c(A-)>c(OH-)>c(H+)
D. 由pH=7溶液计算得: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法正确的是( ) 
A.电极B为负极
B.电极A的反应式为2NH3﹣6e﹣+6OH﹣=N2+6H2O
C.溶液中OH﹣通过阴离子交换膜从左向右迁移
D.当有4.48LNO2(标准状况下)被处理时,转移的电子为0.4mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com