
����Ŀ������һ�ַdz����õĽ���Ԫ�أ��䵥�ʼ��������ڿ��С�������������Ҫ���ã�
��1�����ý����ƺ�CO2��Ӧ���Ʊ����ʯ������ط�Ӧ���Ȼ�ѧ����ʽ���£� 4Na��g��+3CO2��g���T2Na2CO3��l��+C��s�����ʯ����H=a kJmol��1
CO2��g��+4Na��g���T2Na2O��s��+C��s�����ʯ����H=b kJmol��1
��Ӧ6Na2O��s��+2C��s�����ʯ���T8Na��g��+2Na2CO3��l���ġ�H=kJmol��1���ú�a��b�Ĵ���ʽ��ʾ����
��2��T��ʱ�����Ϊ2L�ĺ��������м���һ������Na2SO4������������������·�Ӧ�� Na2SO4��s��+4H2��g��Na2S��s��+4H2O��g����
���������¶ȣ�Kֵ��С����Ӧ�ġ�H0�������������
������˵��������� ��
A������Na2SO4��s�������ɼӿ췴Ӧ����
B�������������ܶ�һ��ʱ���÷�Ӧ�ﵽƽ��״̬
C�������¶Ȳ��䣬��ƽ����ϵ����ͨ��һ������H2 �� ��H����
D�������������䣬�����¶ȣ���v����������v���棩��С��ƽ������
����2min�ڷ�Ӧ�ﵽƽ�⣬��ʱ��������������8g������H2��ʾ�ķ�Ӧ����Ϊ����֪��Ӧ������H2�����������ʱ��Ĺ�ϵ����ͼ��ʾ����T���¸÷�Ӧ��ƽ�ⳣ��Ϊ ��
������Ӧ��ƽ�����һ������H2 �� �ٴ�ƽ���H2O������������������С�����䡱����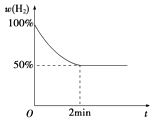
���𰸡�
��1����a��3b��
��2������ AD��0.125mol?L��1?min��1��1������
���������⣺��1����4Na��g��+3CO2��g���T2Na2CO3��l��+C��s�����ʯ����H=a kJmol��1
��CO2��g��+4Na��g���T2Na2O��s��+C��s�����ʯ����H=b kJmol��1
�ɸ�˹���ɿ�֪���٩��ڡ�3�õ���Ӧ6Na2O��s��+2C��s�����ʯ���T8Na��g��+2Na2CO3��l�������H=��a��3b��kJ/mol��
���Դ��ǣ���a��3b������2�����������¶ȣ�Kֵ��С����֪�����¶ȣ�ƽ�������ƶ���������ӦΪ���ȷ�Ӧ����Ӧ�ġ�H��0�����Դ��ǣ�����
��A������Na2SO4��s��������������Ӱ�죬��Ӧ���ʲ��䣬��A����
B����������������Ϊ���������ܶ�Ϊ����������������ܶ�һ��ʱ���÷�Ӧ�ﵽƽ��״̬����B��ȷ��
C�������¶Ȳ��䣬��ƽ����ϵ����ͨ��һ������H2����Ӧ��Ũ������H��Ũ���أ����H���䣬��C��ȷ��
D���÷�ӦΪ���ȷ�Ӧ�������������䣬�����¶ȣ���v��������v���棩��������ƽ�������ƶ�����D����
���Դ��ǣ�AD��
����2min�ڷ�Ӧ�ﵽƽ�⣬��ʱ��������������8g����
Na2SO4��s��+ | 4H2��g��Na2S��s��+4H2O��g�� | ��m |
4 | 64 | |
x | 8 |
��x= ![]() =0.5mol��
=0.5mol��
��H2��ʾ�ķ�Ӧ����Ϊv= ![]() =
= ![]() =0.125 molL��1min��1��
=0.125 molL��1min��1��
��ͼ��֪��������ת����Ϊ50%����ת��������Ϊ0.5mol��ƽ��ʱ����Ϊ0.5mol��ˮ����Ϊ0.5mol����K= ![]() =1��
=1��
���Դ��ǣ�0.125 molL��1min��1��1��
������Ӧ��ƽ�����һ������H2������¶Ȳ��䣬ѹǿ�����÷�ӦΪ�����������ķ�Ӧ��ƽ�ⲻ�ƶ������ٴ�ƽ���H2O������������䣬
���Դ��ǣ����䣮
�����㾫����ͨ��������÷�Ӧ�Ⱥ��ʱ�ͻ�ѧƽ��ļ��㣬�����ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ���Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%�����Խ����⣮


 Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���H+��Na+��NH4+��Mg2+��Fe3+��Al3+��SO42-��HCO3�������ӡ��������Һ�м���һ�����ʵ���Ũ�ȵ�NaOH��Һʱ���������ɳ������ʵ�����NaOH��Һ������仯��ͼ��ʾ������˵����ȷ����

A. ԭ��Һ�к��е�Fe3+��Al3+�����ʵ���֮��Ϊ1:1
B. ab�η��������ӷ�ӦΪ��Al3++3OH��= Al(OH)3����Mg2++2OH��= Mg(OH)2��
C. ԭ��Һ�к��е������ӱض���H+��NH4+��Al3+��Mg2+
D. d����Һ�к��е�����ֻ��Na2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ�����ش�

��1������ȼ�ϵ������ת������Ҫ��ʽ��____________________________________________���ڵ����е�����������Ϊ________(��a��b��ʾ)��
��2��������ӦʽΪ________________________________________________________________��
��3���õ�ع���ʱ��H2��O2�������ⲿ��������ؿ����������ṩ���ܣ�������ȫ�����ǹؼ�����֮һ���������һ����Ҫ�Ĵ�����ϣ�����ͷ���ԭ�����£�
��.2Li��H2===2LiH����.LiH��H2O===LiOH��H2��
�ٷ�Ӧ���еĻ�ԭ����________����Ӧ���е���������________��
�ڽ�������յ�������ų������������ʵ���֮��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ա����ж���ҽԺ�г������ᱵ���ֱ�����Ϊ�ڷ���Ӱ����ҽԺ���ȱ������ж�����ʱ���������⣬����Ҫ���ж���θ�й�����������Һ����֪��ij�¶��£�Ksp��BaCO3��=5.1��10��9 mol2L��2��Ksp��BaSO4��=1.1��10��10 mol2L��2�����ƶ���ȷ���ǣ�������
A.����̼�ᱵ��Ϊ�ڷ���Ӱ��������ΪKsp��BaCO3����Ksp��BaSO4��
B.���ȱ������ж�����ʱ����û�������ƣ�������̼������Һ����
C.������c��Ba2+��=1.0��10��5 molL��1����Һʱ�������������ж�
D.������0.36 molL��1��Na2SO4��Һ���������ж�����ϴθ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ�������
A.���ܴ��ں�������Ų�ʽΪ1s22s22p63s23p64s24p1��ԭ��
B.�������Ų���ͬһ�ܼ��IJ�ͬ���ʱ���������ȵ���ռ��һ��������������������෴
C.������ĵ���ʽ�� ![]()
D.��̬ԭ�ӵĵ��ӻ��һ��������Ϊ����̬ԭ�ӣ�������̬ԭ�ӱ�Ϊ��̬ԭ�ӣ���Ҫ�ų�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ǻ�ѧѧϰ���о��ij��÷��������з�����ȷ������ ��
A. ����ˮ��������ˮ���������֡�����ϩ
B. CO2��NO2��P2O5�����������Na2O��Na2O2������������
C. �����ܷ��������ЧӦ������ɢϵ��Ϊ��Һ���������Һ
D. ������Һ��������ǿ����������ʷ�Ϊǿ����ʺ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڼ����������ȷ���ǣ� ��
A.������ӵ����幹�����������壬���ԣ�CH2Cl2�����ֲ�ͬ����
B.�����������������ȡ����Ӧ����ˣ�����ʹ��ˮ��ɫ
C.������ʹ����KMnO4��Һ��ɫ
D.�����ܹ�ȼ�գ���һ�������»ᷢ����ը����ˣ��ǿ�ȫ����Ҫ��в֮һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� 0.50molL��1NaOH��Һ10.00mL����δ֪Ũ�ȵ�����20.00mLǡ�õζ����յ㣬����˵����ȷ���ǣ�������
A.��ѡ�÷�̪��ָʾ�����յ�ʱ��Һ��ǡ����ɫ
B.����Ͳ��ȡ��������
C.���ζ���ϣ��ζ��ܼ�������һ��Һ�壬�����������Ũ��ƫ��
D.�����Ũ��Ϊ1.00 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ�أ�����B��C��D��EΪ����������Ԫ�أ�F��GΪ��������Ԫ�أ����ǵ�ԭ����������������������������Ϣ���ش�����
BԪ��ԭ�ӵĺ���p��������s��������1 |
Cԭ�ӵĵ�һ�����ĵ����ֱܷ��ǣ�I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
Dԭ�Ӻ�������p���ȫ������� |
EԪ�ص����������������������4 |
F ��ǰ������ԭ�ӵ����Ų�ͼ�е�����������Ԫ�� |
G�����ڱ��ĵ�ʮһ�� |
��1��B��̬ԭ�ӵĵ����Ų�ʽΪ��F��̬ԭ�ӵļ۵����Ų�ʽΪ��G��̬ԭ�ӵ����������Ų�ͼΪ ��
��2��C��������������Ԫ��ԭ�ӵĵ�һ�������ɴ�С��˳��������Ԫ�ط�����գ���
��3��B��D�ĵ縺����Դ�С��BD���á����ڡ�����С�ڡ����ڡ���գ���
��4����������Ԫ���У�λ��s�������֣�λ��p�������֣�
��5��DE3�ĵ���ʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com